Fístulas arteriovenosas nativas: factores de riesgo implicados en el fallo primario de maduración
Francisco Javier Rubio-Castañeda1, Manuel Fernández-Núñez1, Ana Isabel Sierra-Sánchez1, María Amaya Mateo-Sánchez1, Víctor Cantín-Lahoz1, Emilia Ferrer-López1
1 Unidad de Hemodiálisis. Hospital Universitario Miguel Servet, Zaragoza. España
https://doi.org/10.37551/S2254-28842024024
Como citar este artículo:
Rubio-Castañeda FJ, Fernández-Núñez M, Sierra-Sánchez AI, Mateo-Sánchez MA, Cantín-Lahoz V, Ferrer-López E.
Fístulas arteriovenosas nativas: Factores de riesgo implicados en el fallo primario de maduración.
Enferm Nefrol. 2024;27(3):228-36
Correspondencia:
|
Recepción: 19-07-24
|
RESUMEN
Objetivo: El fallo primario incluye la trombosis precoz y los fallos de maduración.
Objetivos: Determinar los factores de riesgo asociados al fallo primario de fístulas nativas y su relación con la supervivencia. Analizar las diferencias ecográficas entre fístulas maduras y fístulas con fallos de maduración.
Material y Método: Estudio observacional y retrospectivo. Variables: sociodemográficas, antropométricas, comorbilidades, parámetros sanguíneos y ecográficos. Análisis estadístico: Descriptivo. Regresión logística. Método de Kaplan-Meier.
Resultados: Muestra 65 fístulas nativas, 72,3% hombres. Edad 69,7 años. 60% fístulas maduras y 40% fístulas con fallo primario (20% fallo de maduración y 20% trombosis precoz). Factores de riesgo de fallos de maduración: diámetros arteriales <2 mm (OR:16,8;p=0,016). Factores de riesgo de trombosis precoz: Edad =65 años (OR:5,44;p=0,014), peso (OR:1,04;p=0,02) e índice de masa corporal (OR:1,17; p=0,027). Monocitos factor protector de trombosis precoz (OR:0,0142;p=0,029).
Personas =65 años, obesas y con diámetros arteriales <2 mm presentaron menor supervivencia. Diámetro de vena, velocidad pico sistólica y flujo del acceso vascular significativamente mayores en fístulas maduras(p<0,001).
Conclusiones: Fístulas realizadas con diámetros arteriales <2 mm presentan mayor riesgo de fallos de maduración. A mayor edad, peso e índice de masa corporal mayor riesgo de trombosis precoz. A menos monocitos, menos riesgo de trombosis precoz. La edad, el diámetro arterial, y el peso influyen en la supervivencia. Existen diferencias ecográficas entre fístulas maduras y fístulas con fallos de maduración.
Palabras clave: hemodiálisis; fístula arteriovenosa nativa; fallo primario; ecografía doppler; supervivencia.
ABSTRACT
Native arteriovenous fistulae: Risk factors involved in primary maturation failure
Introduction: Primary failure includes early thrombosis and maturation failures.
Objectives: To determine the risk factors associated with primary failure of native fistulas and their relationship with survival. To analyse the sonographic differences between mature fistulas and fistulas with maturation failure.
Material and Method: Observational and retrospective study. Variables: sociodemographic, anthropometric, comorbidities, blood and ultrasound parameters. Statistical analysis: Descriptive. Logistic regression. Kaplan-Meier method.
Results: Sample 65 native fistulas, 72.3% male. Age 69.7 years. 60% mature fistulas and 40% fistulas with primary failure (20% maturation failure and 20% early thrombosis). Risk factors for maturation failure: arterial diameters <2mm (OR:16.8; p=0.016). Risk factors for early thrombosis: age =65 years (OR:5.44; p=0.014), weight (OR:1.04;p=0.02) and body mass index (OR:1.17;p=0.027). Monocytes as a protective factor for early thrombosis (OR:0.0142; p=0.029).
People = 65 years old, obese, and with arterial diameters <2mm had lower survival. Mature fistulas had a significantly higher vein diameter, peak systolic velocity, and vascular access flow (p<0.001).
Conclusions: Fistulas performed with arterial diameters <2mm present a higher risk of maturation failure. The higher the age, weight, and body mass index, the higher the risk of early thrombosis. The fewer monocytes, the lower the risk of early thrombosis. Age, arterial diameter, and weight influence survival. There are ultrasound differences between mature fistulae and fistulae with maturation failure.
Keywords: haemodialysis; native arteriovenous fistula; primary failure; doppler ultrasound; survival.
INTRODUCCIÓN
En nuestro país, el 78,4 % de los pacientes con enfermedad renal crónica avanzada eligieron la hemodiálisis (HD) como tratamiento renal sustitutivo1. El acceso vascular es el factor más importante que determina el éxito o fracaso de los programas de HD2,3. La fístula arteriovenosa nativa (FAVn) es el acceso vascular de elección por su mayor permeabilidad a largo plazo, y por su menor tasa de complicaciones, gasto sanitario y mortalidad en comparación con las fístulas arteriovenosas protésicas y los catéteres venosos centrales3-6.
La maduración es un proceso que se inicia tras la creación de la anastomosis arteriovenosa y finaliza cuando la FAVn es apta para hemodiálisis. Una FAVn es apta para HD cuando el diámetro de la vena es = 4 mm y el flujo del acceso vascular es = 500 ml/min7-9. Estos parámetros se alcanzan, por lo general, a partir de las 6 semanas de maduración, aunque puede demorarse hasta los 3-6 meses7. Durante el proceso de maduración, se produce un aumento de la presión y del flujo de sangre en el interior del vaso que provoca una remodelación vascular y una dilatación del vaso sanguíneo3,5,10,11. La remodelación vascular se ve afectada por la edad, factores quirúrgicos y las comorbilidades de los pacientes, estos factores favorecen los problemas de maduración de las FAVn y las trombosis de los accesos vasculares5,6,11,12.
El fallo primario se produce cuando una FAVn no es apta para HD a los tres meses de maduración, e incluye la trombosis precoz y los fallos de maduración de las FAVn2,11-14. Se estima que entre el 20-50% de las fístulas arteriovenosas sufren fallo primario7,11,14,15. Criterios clínicos y ecográficos son empleados para determinar si una FAVn presenta fallos de maduración o trombosis precoz11.
Existen una serie de factores que han sido asociados históricamente con los fallos primarios de FAVn: edad, sexo femenino, comorbilidades (diabetes, obesidad, hipertensión), la inflamación crónica, alteraciones analíticas, así como el diámetro de la arteria y vena empleadas en la realización de la FAVn3,4,6,11,14,16,17. Sin embargo, el rol de estos factores en el fallo primario y en la supervivencia de las FAVn no está claramente definido14.
Por lo tanto, el objetivo general de este estudio es determinar los factores de riesgo asociados al fallo primario de las FAVn en los pacientes en HD. Como objetivos específicos:
– Establecer la relación entre los factores de riesgo asociados al fallo primario y la supervivencia acumulada de las FAVn.
– Determinar las diferencias ecográficas entre las FAVn maduras y las FAVn con fallos de maduración en los primeros tres primeros meses después de su realización.
MATERIAL Y MÉTODO
Diseño y ámbito: Estudio observacional, con recogida de información retrospectiva, realizado entre febrero y marzo de 2024 en la Consulta de Acceso Vascular de Hemodiálisis del Hospital Universitario Miguel Servet de Zaragoza.
Población y muestra: Pacientes en HD a los que se realizó una FAVn en el hospital entre el 1 de enero de 2023 y el 31 de enero de 2024.
Criterios de inclusión: pacientes mayores de 18 años, que tengan una FAVn con =3 meses de maduración a fecha del 31 de enero de 2024, y pacientes con FAVn trombosadas en los primeros tres meses de maduración. Criterios de exclusión: pacientes con FAVn reparadas quirúrgicamente en los primeros tres meses de maduración, y pacientes con fístulas arteriovenosas protésicas.
En aquellos pacientes en los que se realizó más de una FAVn durante el periodo analizado, se consideró cada acceso vascular de forma independiente, aunque estos fueran de un mismo paciente.
Variables del estudio
Sociodemográficas: edad (años) y sexo (hombre, mujer). Medidas antropométricas: peso (kg), talla (metros) e índice de masa corporal (IMC). Comorbilidades de interés: hipertensión arterial, diabetes, enfermedad arterial periférica, hiperparatiroidismo y dislipemia. Características de las FAVn: tipo de FAVn (radiocefálica, humerocefálica, humerobasílica), y diámetro de la arteria y vena empleadas para la creación de la FAVn (mm). Parámetros analíticos: PH, bicarbonato (mmol/l) , PCO2 (mmHg), PO2 (mmHg), potasio (mmol/l), PTH (pg/ml), hierro (µg/dl), ferritina (ng/dl), proteína C reactiva (mg/dl), urea (mg/dl), creatinina (mg/dl), calcio (mg/dl), fósforo (mg/dl), colesterol total (mg/dl), triglicéridos (mg/dl), albúmina (g/dl), recuento total glóbulos blancos (10^3/µl), neutrófilos (10^3/µl), monocitos (10^3/µl), linfocitos (10^3/µl), hemoglobina (g/dl), hematocrito (%) y plaquetas (10^3/µl)3,11,14,15,16,18. Todas estas variables se recogieron de la historia clínica electrónica.
La analítica más próxima a la realización de la FAVn fue la empleada para obtener los datos de los análisis sanguíneos14. El IMC se calculó empleando el índice de Quetelet: peso (kg) / talla2 (metros), y se categorizó siguiendo la clasificación propuesta por la OMS: normopeso (18,5-24,9 kg/m2), sobrepeso (25-29,9 kg/m2) y obesidad (IMC=30 kg/m2)19. Asimismo, se categorizó la edad (=65 años y <65 años)3,4,11,14,15,20, y el diámetro de la arteria (=2 mm y <2 mm)7,8,9,16,18 y vena (=2,5 mm y <2,5 mm)7,8,16,18,20 empleados para realizar la FAVn.
El resto de las variables se obtuvieron por ecografía doppler. Se realizaron tres controles ecográficos a las FAVn a los 15, 45 y 90 días de maduración. Las ecografías las realizaron el nefrólogo y el enfermero de la consulta del Acceso Vascular de Hemodiálisis empleando un ecógrafo modelo Hitachi-Aloka F31. Los datos ecográficos obtenidos fueron: diámetro de la anastomosis (mm), velocidad pico sistólica (VPS) de la anastomosis y de la arteria humeral (cm/s), índice de resistencia de la anastomosis y de la arteria humeral, diámetro de la vena (mm) y flujo del acceso vascular (QA) (ml/min). Todas las mediciones del QA y del diámetro de la vena se realizaron en las mismas ubicaciones: el QA se midió tres centímetros por encima de la bifurcación de la arteria humeral, y el diámetro de la vena se midió a tres centímetros de la anastomosis arteriovenosa21. Estas mediciones no se realizaron en las FAVn trombosadas. Para obtener el QA, se realizaron tres mediciones y se obtenía la media.
También se recogió la presencia o no de fallo primario así como el tipo de fallo, según fuera trombosis precoz (TP) o fallo de maduración (FM); para ello se utilizaron los siguientes criterios diagnósticos:
– Trombosis precoz: trombosis que ocurría en los tres primeros meses de maduración2,13,17. Se diagnosticaba mediante exploración física (ausencia de thrill y soplo), y ecográfica (ausencia de compresibilidad de la vena, ausencia de flujo tanto doppler como color, y presencia de ondas de alta resistencia en la arteria nutricia). Ante la presencia de todos estos signos se establecía el diagnóstico de trombosis precoz de la FAVn7-9.
– Fallo de maduración: Una FAVn se consideró madura cuando presentaba un QA =500 ml/min y diámetro de la vena =4 mm a los tres meses de maduración7-9,11. Por lo tanto, las FAVn presentaban FM cuando no cumplían ambos criterios a los tres meses de maduración.
Consideraciones éticas: Para realizar este estudio se obtuvieron los permisos del Hospital Universitario Miguel Servet y del Comité de Ética de la Investigación de la Comunidad Autónoma de Aragón (CEICA), informe dictamen CEICA (C.I. PI24/032). Este comité autorizó la exención del consentimiento informado porque los datos extraídos de la historia clínica electrónica eran anonimizados.
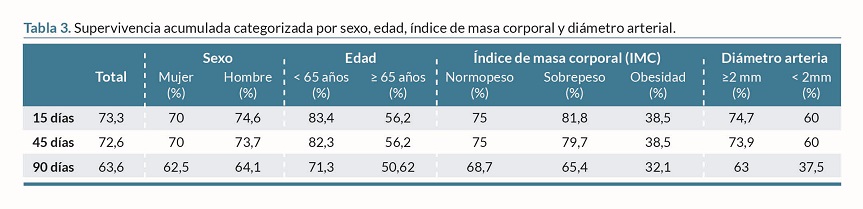
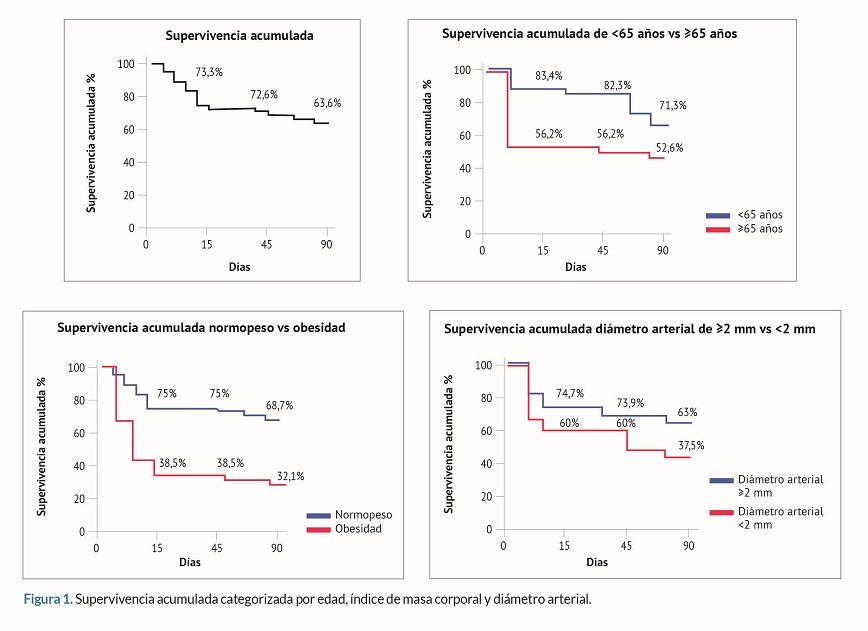
Análisis estadístico: Se empleó el programa Jamovi® versión 2.3.28. Para analizar la normalidad de la distribución de las variables cuantitativas estudiadas se utilizó el test de Shapiro-Wilk. Las variables cuantitativas se expresaron en medidas de tendencia central (media y mediana) y medidas de dispersión (desviación estándar y rango intercuartílico) según siguieran o no una distribución normal. La comparación entre variables cuantitativas se realizó mediante la prueba de t de Student para muestras independientes (distribución normal) y el test de la U de Mann-Whitney (distribución no normal). Las variables cualitativas se expresaron en frecuencia y porcentaje. La comparación entre variables cualitativas se analizó empleando tablas de contingencia mediante la prueba del Chi cuadrado o el test exacto de Fisher según correspondiera. Los factores de riesgo de FM y TP se identificaron mediante regresión logística univariante y multivariante. El método Kaplan-Meier se empleó para calcular la supervivencia de las FAVn a los 15, 45, 90 días de maduración. Además, se calculó la supervivencia por sexo, edad, IMC y diámetro de la arteria empleada para realizar la FAVn. Se consideró significación estadística p <0,05.
RESULTADOS
La muestra estuvo formada por 65 FAVn correspondientes a 63 pacientes. La mediana de edad fue de 69,7 (RI:43-85) años. El 72,3% eran hombres (n=47) y el 27,7% mujeres (n=18). El 66% presentó FAVn radio-cefálicas (n=44), el 20% húmero-cefálicas (n=13) y el 12,3 % húmero-basílicas (n=8) (tabla 1).
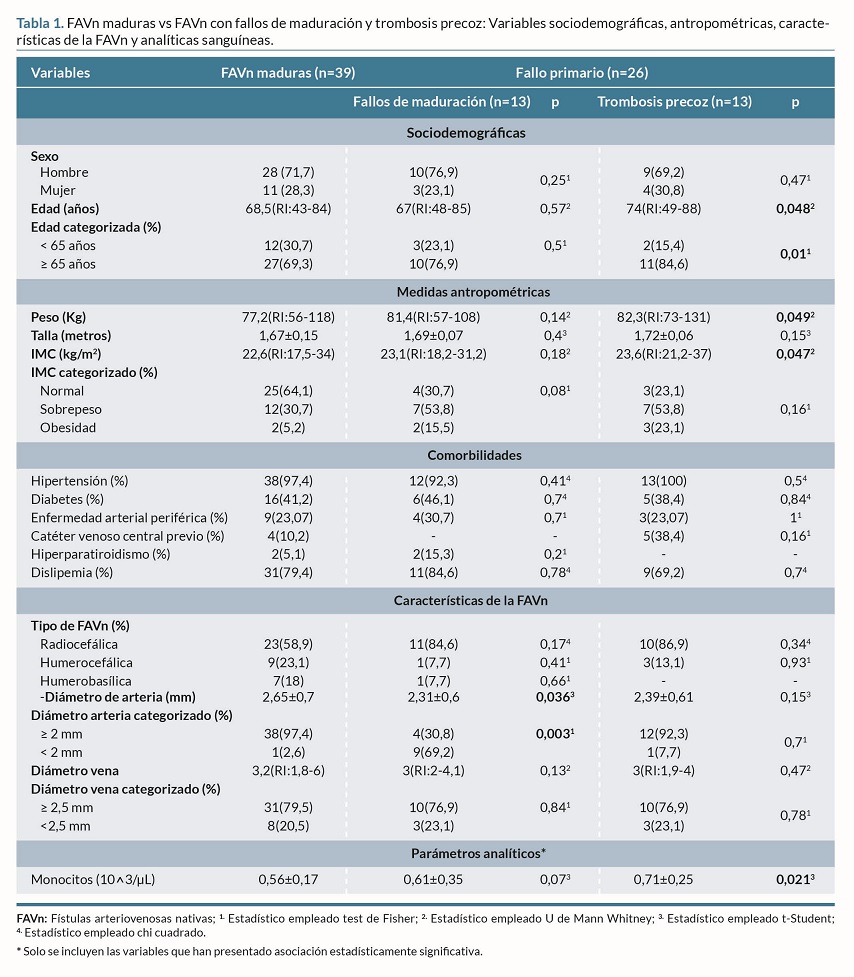
El 60% (n=39) de la muestra eran FAVn maduras y el 40% (n=26) FAVn con fallo primario (20% FM (n=13) y otro 20% TP (n=13)) (tabla 1).
Se encontró asociación estadísticamente significativa entre el FM de las FAVn y el diámetro de la arteria empleada para realizar la FAVn (p= 0,036). Además, la TP de las FAVn, se asoció significativamente con la edad (p=0,048), el peso (p=0,049), IMC (p=0,047) y los monocitos (p=0,021) (tabla 1).
El análisis univariante sobre los factores de riesgo asociados a los FM, reveló que usar diámetros arteriales <2 mm para realizar FAVn es un factor de riesgo de FM (OR: 16,8; IC: 1,67-169; p=0,016). En el análisis multivariante, se observó que el uso de diámetro arteriales <2mm para realizar FAVn era un factor de riesgo independiente en los FM (OR: 20,12; IC:1,55-283; p=0,020) (tabla 2).
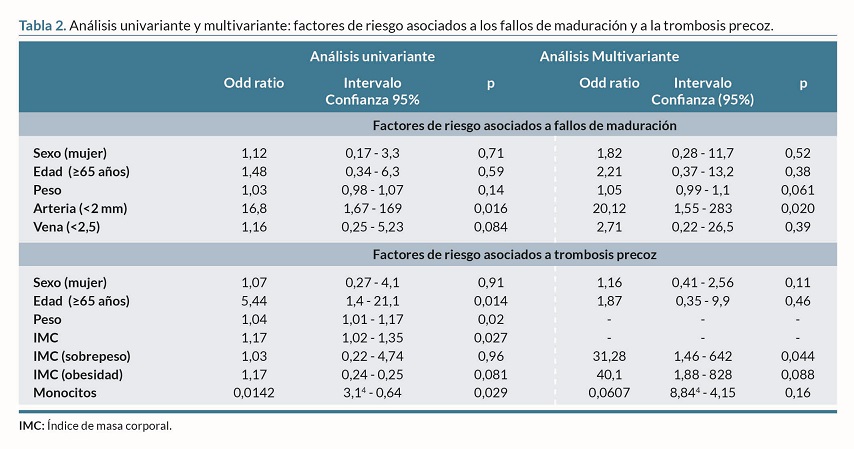
El análisis univariante sobre los factores de riesgo asociados a la TP, mostró que la edad =65 años (OR: 5,44; IC: 1,4-21,1; p=0,014), el peso (OR: 1,04; IC: 1,01-1,17; p= 0,02) y el IMC (OR: 1,17; IC: 1,02-1,35; p=0,027) son factores de riesgo de TP. Por el contrario, los monocitos actuaban como factor de protección, a menor cantidad de monocitos menor riesgo de TP (OR: 0,0142; IC: 3,1- 4 – 0,64; p=0,029). El análisis multivariante, reveló que presentar sobrepeso es un factor de riesgo independiente para la TP (OR: 31,28; IC: 1,46-642, p =0,044) (tabla 2).
La supervivencia acumulada de las FAVn a los 15, 45 y 90 días de maduración fue de 73,3%, 72,6% y 63,6% respectivamente. Las personas =65 años, con FAVn realizadas con diámetros arteriales <2 mm y con obesidad, presentaban menor supervivencia acumulada a los 15, 45 y 90 días de maduración. La supervivencia acumulada se reducía drásticamente a los 90 días de maduración en los pacientes =65 años (50,6%), en pacientes con FAVn realizadas con un diámetro arterial <2 mm (37,5%) y en pacientes con obesidad (32,1%) (tabla 3 y figura 1).
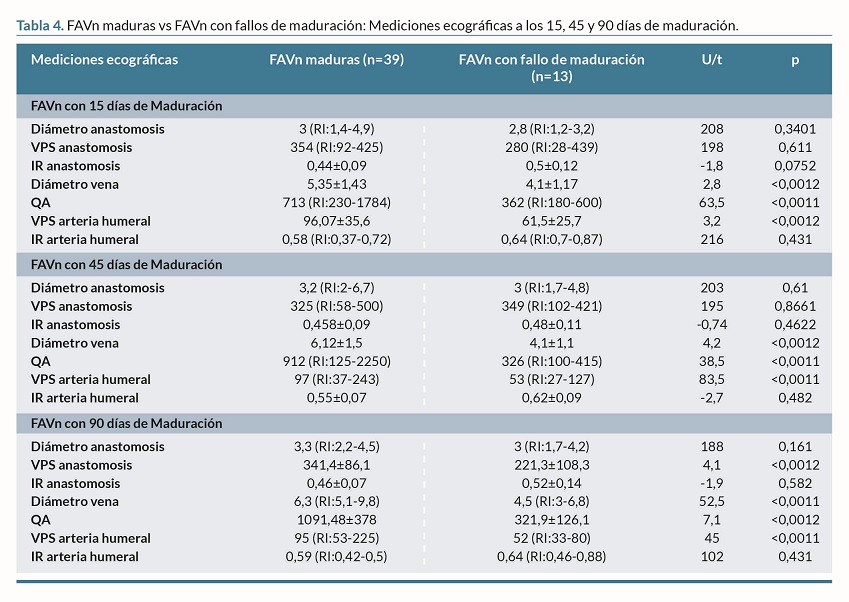
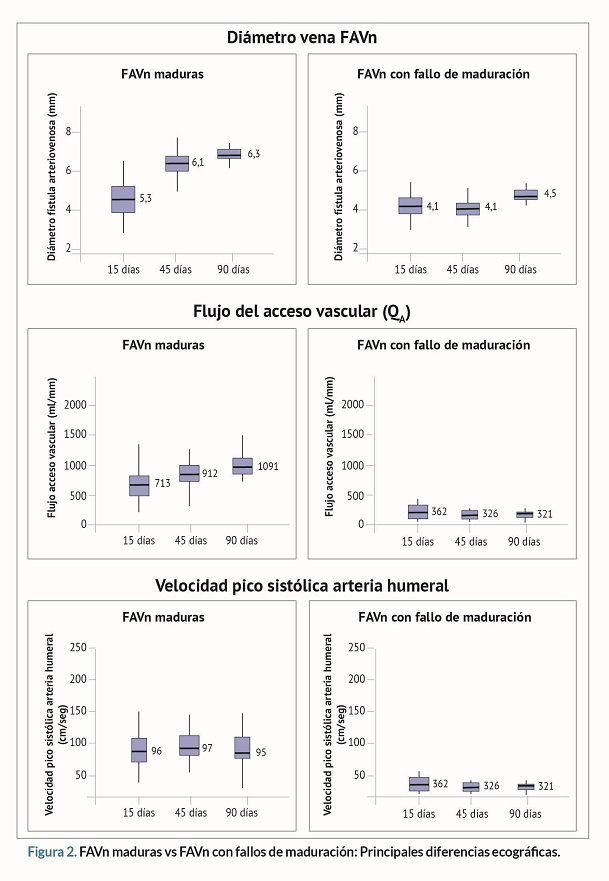
Se realizó seguimiento ecográfico a los 15, 45, y 90 días de maduración a 52 FAVn, el 75 % fueron FAVn maduras (n=39), y un 25% fueron FAVn con FM (n=13). En todas las mediciones ecográficas, el diámetro de la vena, el QA y la VPS en la arteria humeral fueron significativamente mayores en las FAVn maduras vs FAVn con FM (p <0,001). Además, se encontró que la VPS de la anastomosis a los 90 días de maduración era significativamente mayor en las FAVn maduras vs FAVn con FM (p <0,001) (tabla 4 y figura 2).
DISCUSIÓN
Un 40% de las FAVn presenta fallo primario (20% FM y otro 20% TP). Estos datos concuerdan con la literatura consultada, donde la tasa de fallo primario se sitúa entre el 20-50%11,14,15, los FM entre el 16-30%2,11,14,22 y la TP entre el 5-30%2,11,17. Además, las variables asociadas al fallo primario de nuestro estudio (edad =65 años, peso e IMC elevados, los niveles bajos de monocitos y emplear diámetros arteriales <2 mm para realizar FAVn) coinciden con la bibliografía consultada3,4,6,11,14,16,23. En relación al tipo de fallo primario, todas las variables, a excepción del diámetro arterial <2 mm, están relacionadas con la TP de las FAVn. Mientras que emplear diámetros arteriales <2 mm para realizar FAVn se relaciona con los FM de las FAVn.
Se han encontrado dos artículos que relacionan la edad avanzada con un mayor riesgo de fallo primario; Delgado Ramírez et al. establecen en su revisión sistemática que la edad avanzada aumenta el riesgo de fallo primario en un 50%3, y Pérez-Reyes et al. indican que el riesgo de fallo primario aumenta un 1% al año a partir de los 67 años4. En nuestro estudio, las personas =65 años presentan más riesgo de sufrir TP de las FAVn. Sin embargo, no encontramos bibliografía que relacionase la edad avanzada con la TP de las FAVn. Por el contrario, sí encontramos un artículo de Bashar et al. que relacionaba la edad avanzada con los FM de las FAVn15.
Actualmente, no está claro el impacto que el peso tiene en la permeabilidad de las FAVn14. Sin embargo, nuestros datos y los de otros autores indican que a mayor peso mayor riesgo de fallo primario4,11. En relación al IMC, observamos que IMC elevados se asocian con fallo primario de FAVn, de hecho, personas con IMC =25 kg/m2 tienen 2,4 veces más riesgo de padecer fallo primario23. Asimismo, los resultados del presente estudio, revelan que las personas con un peso e IMC elevados presentan más riesgo de TP de las FAVn. La inflamación asociada a la obesidad y a la aterosclerosis puede provocar una lesión endotelial y un menor flujo sanguíneo que podría favorecer la trombosis14.
Solamente hemos encontrado un artículo que analiza la relación entre los monocitos y el fallo primario de FAVn, y cuyos resultados son similares a los nuestros. BojaKoswki et al.24 indican que los monocitos son un factor de riesgo independiente de fallo primario, y que a menor cantidad de monocitos menor riesgo de fallo primario (odds ratio 0,02; p<0,001). Además, en nuestro estudio encontramos relación entre los monocitos y la TP de las FAVn, observando que, a menor cantidad de monocitos menor riesgo de TP. Los monocitos juegan un papel importante en la cascada de coagulación al activar el factor tisular, este factor desencadena la generación de trombina y la formación de un trombo25, esto podría explicar la relación existente entre los monocitos y la trombosis de las FAVn.
Uno de los factores más estudiados en el fallo primario es el diámetro arterial empleado en la realización de las FAVn7. En nuestro caso, observamos que emplear diámetros arteriales <2 mm para la realizar FAVn aumenta el riesgo de FM. Nuestros resultados, coinciden con los de Ibeas et al.9, Iglesias et al.8 y con la guía de la GEMAV7, quienes indican que emplear diámetros arteriales <2 mm para realizar FAVn influye negativamente en la maduración de las FAVn.
No encontramos bibliografía que calculase la supervivencia acumulada de las FAVn en los tres primeros meses de maduración. Sólo en el estudio de Mateos-Torres et al.18 calculan la supervivencia acumulada al mes de maduración, en el resto de los artículos lo hacen a los 6 meses, al año o dos años11,14. Mateos-Torres et al.18 obtienen una supervivencia acumulada al mes del 97,5%, mucho mayor que la nuestra a los 45 días de maduración, si bien, ellos excluyeron de su estudio las FAVn realizadas con diámetros de arterias arteriales <2 mm. Por el contrario, sí encontramos bibliografía sobre los factores que afectan a la supervivencia de la FAVn. Nuestro estudio y la bibliografía consultada, coinciden en que las personas = 65 años3,4,15, los obesos3,11,14 y las personas con FAVn realizadas con un diámetro arterial <2 mm7 presentan una menor supervivencia de las FAVn.
Las principales diferencias ecográficas entre las FAVn maduras y las FAVn con FM son el diámetro de la vena, el QA, y la VPS de la arteria humeral. Estos datos concuerdan con los de Muray-Cases et al.11, quienes hallaron que las FAVn maduras presentan diámetros venosos y QA significativamente mayores que las FAVn con FM, aunque estos autores no miden la VPS.
La principal limitación de este estudio es de tipo metodológico. El tamaño muestral es pequeño, lo que implica una mayor amplitud en algunos intervalos de confianza, y, por tanto, una menor precisión de los parámetros.
A partir de nuestros resultados, podemos concluir que los factores de riesgo asociados al fallo primario son el emplear diámetros arteriales <2 mm para realizar FAVn, peso e IMC elevados, los niveles de monocitos y edad =65 años. En relación a los fallos de maduración y la trombosis precoz de las FAVn, observamos que emplear diámetros arteriales <2 mm para realizar FAVn aumenta el riesgo de fallos de maduración, y que a mayor edad, peso e IMC mayor riesgo de presentar trombosis precoz. Por el contrario, a menor cantidad de monocitos menor riesgo de trombosis precoz.
La supervivencia acumulada es menor en los pacientes =65 años, con diámetros arteriales <2 mm, y obesos. Las FAVn maduras presentan, en todas las mediciones ecográficas, mayor VPS en arteria humeral, QA y diámetro de la vena que las FAVn con fallos de maduración.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de interés.
Financiación
Los autores declaran no haber recibido financiación alguna.
BIBLIOGRAFÍA
1. Registro Español de Enfermos Renales (REER) Informe 2022 (datos preliminares). Sociedad Española de Nefrología [Internet]. 2023 [consultado 30 Mar 2024)]; Disponible en: https://www.ont.es/wp-content/uploads/2023/11/Memoria_REER_2022.pdf
2. Gjorgjievski N, Dzekova-Vidimliski P, Gerasimovska V, Pavleska-Kuzmanosvka S, Gjorgievska J, Dejanov P, et al. Primary failure of the arteriovenous fistula in patients with chronic kidney disease stage 4/5. Maced J Med Sci. 2019;7(11):1782-7.
3. Delgado-Ramirez A, Ruíz-Gárcia E, Latorre-López L, Crespo-Montero R. Factores que influyen en la supervivencia de la fístula arteriovenosa interna y su relación con la técnica de punción. Enferm Nefrol. 2016;19(3):215-30.
4. Pérez-Reyes M, Rodríguez-Delgado L, Olivares-Collado E, Crespo-Montero R. El acceso vascular en el paciente anciano en hemodiálisis: resultados y supervivencia. Enf Nefrol. 2023;26(3):207-18.
5. Gameiro J, Ibeas J. Factors affecting arteriovenous fistula dysfunction: A narrative review. J Vasc Access. 2020;21(2):134-47.
6. Aragoncillo-Sauco I, Ligero-Ramos J, Vega-Martínez A, Morales-Muñoz A, Abad-Estébanez S, Macías-Carmona N, et al. Consulta de acceso vascular: resultados antes y después de la instauración de un programa multidisciplinar con realización de ecografía doppler de rutina. Nefrología 2018;38(6):616-21.
7. Ibeas J, Roca-Tey R, Vallespín J, Moreno T, Moñux G , Martí-Monrós A, et al. Guía clínica española del acceso vascular para hemodiálisis. Nefrología. 2017;37:1-177.
8. Ibeas J, Iglesias R, Merino J, Rubiela C, Vallespin J, Vinuesa X. Manual de ecografía para la exploración del acceso vascular. EDTNA/ERCA Madrid. 2019.
9. Ibeas J, Vallespin J. Ecografía del acceso vascular para hemodiálisis: conceptos teóricos y prácticos. Criterios. Nefrologia. 2012;3(6):21-35.
10. Browne L, Bashar K, Griffin P, Kavanagh E, Walsh S, Walsh M. The role of shear stress in arteriovenous fistula maturation and failure: A systematic review. PLoS One. 2015;10(12):e0145795.
11. Muray-Cases S, García-Medina J, Pérez-Abad JM, Andreu-Muñoz AJ, Ramos-Carrasco F, Pérez-Pérez A, et al. Importancia del seguimiento del fracaso de maduración en la fístula arteriovenosa radio-cefálica en prediálisis. Papel de la ecografía. Nefrología. 2016;36(4):410-17.
12. Hu H, Patel S, Hanisch J, Santana J, Hashimoto T, Bai H, et al. Future research directions to improve fistula maturation and reduce access failure. Semin Vascu Surg. 2016;29(4):153-71.
13. Venkat-Ramanan S, Attur-Prabhu R, Ramachandra-Rao I, Chawla A, Vinayak-Shenoy S, Prasad-Nagaraju S, et al. Outcomes and predictors of failure of arteriovenous fistulae for hemodialysis. Int Urol Nephrol. 2022.54:185-92.
14. Zhang F, Li J, Yu J, Jiang Y, Xiao H, Yang Y, et al. Risk factors for arteriovenous fistula dysfunction in hemodialysis patients: a retrospective study. Sci Rep. 2023;13(1):21325.
15. Bashar K, Zafar A, Elsheikh S, Healy D, Clarke-Moloney M, Casserly L, et al. Predictive parameters of arteriovenous fistula functional maturation in a population of patients whith end- stage renal disease. Plos One. 2015;10(3):e0119958.
16. Monte FJ, Sierra-Juárez MA, Lacayo-Valenzuela M, Olivares-Cruz S. Características clinicopatológicas que determinan el pronóstico de maduración de una fístula arteriovenosa. Rev Mex Angiol. 2022;50(4):140-4.
17. Sosa-Vázquez OR. Fístulas arteriovenosas trombosadas para hemodiálisis y su tratamiento. Rev Cuba Angiol. 2017;18(2):192-201.
18. Mateos-Torres E, Collado-Nieto S, Cao-Baduell H, Lacambra-Peñart M, Velescu A, Clará-Velasco A. Utilidad de la valoración ecográfica previa a la realización del primer acceso vascular para hemodiálisis. Nefrología. 2019;39(5):539-44.
19. WHO. Obesity: preventing and managing the global epidemic. Report of a WHO Consultation. WHO Technical Report Series 894. Geneva: World Health Organization, 2000.
20. Bashar K, Conlon PJ, Kheirelseid E, Aherbe T, Walsh S, Leahy A. Aretriovenous fistula in dialysis patients: factors implicated in early and late AVF maturation failure. The Surgeon. 2016;14(5):294-300.
21. Tapia-González I. Estrategias terapéuticas para la maduración de fístulas arteriovenosas nativas para la hemodiálisis. Tesis Doctoral. Universidad Autónoma de Barcelona. 2021.
22. Ayala Strub MA, Manzano Grossi MS, Ligero Ramos JM. Fístulas Arterio-Venosas para Hemodiálisis. En: Lorenzo V., López Gómez JM (Eds). Nefrología al día. [Internet]. 2024 [consultado 12 Feb 2024]. Disponible en: https://www.nefrologiaaldia.org/332
23. King JK. Obesity-related decrease in intraoperative blood flow is associated whith maturation failure of radiocephalic arteriovenous fistula. J. Vasc. Surg. 2015;62(4):1010-17.
24. Bojakowski K, Dzabic M, Kurzejamska E, Styczynski G, Andziak PGaciong Z, Söderberg-Nauclér C, Religa P. A high red blood cell distribution width predicts failure of arteriovenous fistula. PLoS One. 2012;7(5):e36482.
25. Sambola A, Fuster V, Badomin JJ. Papel de los factores de riesgo en la trombogenicidad sanguínea y los síndromes coronarios agudos. Rev Esp Cardiol. 2003;56(10):1001-09.
Este artículo se distribuye bajo una Licencia Creative Commons Atribución–NoComercial 4.0 Internacional.
https://creativecommons.org/licenses/by-nc/4.0/
