Ganancia de peso y modificación de la composición corporal después de un trasplante renal
Emilia Ferrer-López1, Francisco Javier Rubio-Castañeda1, María Amaya Mateo-Sánchez1, Manuel Fernández-Núñez1, Ana Isabel Sierra-Sánchez1, Víctor Cantín-Lahoz1
1Unidad de Hemodiálisis y Trasplante Renal. Hospital Universitario Miguel Servet de Zaragoza. España
https://doi.org/10.37551/S2254-28842023023
Como citar este artículo:
Ferrer-López E, Rubio-Castañeda FJ, Mateo-Sánchez MA, Fernández-Núñez M, Sierra-Sánchez AI, Cantín-Lahoz V.
Ganancia de peso y modificación de la composición corporal espués de un trasplante renal.
Enferm Nefrol 2023;26(3):241-9
Correspondencia:
|
Recepción: 30-07-2023
|
RESUMEN
Introducción: Esta constatado un aumento de peso postrasplante renal, entre otros factores, por una reducción de la actividad física en los primeros meses, aumento del apetito y toma de inmunosupresores y corticoides.
Objetivos: Conocer la ganancia de peso postrasplante. Determinar relación entre ganancia de peso y comorbilidades. Evaluar la modificación de la composición corporal.
Material y Método: Estudio prospectivo, septiembre 2020-abril 2023. Se realizaron mediciones de peso a los 0, 3, 6 y 12 meses.
Resultados: Se analizaron 92 pacientes, 68,5% varones, edad 58±18,5 años. Peso pretrasplante 72,5 (±5,8), a los 12 meses: 75,10 (±15,7) kg. Se encontraron diferencias entre primero y trasplantes previos (p=0,020).
En el análisis de las varianzas de medidas repetidas de peso (p=0,022), las diferencias se mostraron entre el mes 0 y el tercero, el mes 0 y el año y, entre el tercer mes y el año.
En la masa muscular (p<0,001), se vieron al comparar el mes 0 con 3º, con 6º y con 12 meses. La masa grasa al comparar 3er mes con 12 meses y la grasa visceral (p=0,032), al comparar 3er mes con 6º y con 12 meses.
Conclusión: Tras el trasplante renal se produce un aumento de peso, especialmente a partir del 6º mes, situándose en un 5% al año. La masa muscular aumenta en mayor medida que la masa grasa. Las personas trasplantadas de donante vivo, trasplante previos, con hipertensión y/o enfermedad cardiovascular tienen mayor ganancia de peso.
Palabras clave: trasplante de riñón; composición corporal; sobrepeso; obesidad; factores de riesgo cardiometabólico.
ABSTRACT
Weight gain and changes in body composition after a kidney transplant
Introduction: Weight gain after kidney transplant has been documented, among other factors, due to reduced physical activity in the early months, increased appetite, and the use of immunosuppressants and corticosteroids.
Objetives: To understand post-transplant weight gain. Indeed, to determine the relationship between weight gain and comorbidities, as well as, to evaluate changes in body composition.
Material and Method: Prospective study, September 2020 to April 2023. Weight measurements were taken at 0, 3, 6, and 12 months.
Results: Ninety-two patients were analyzed, 68.5% male, with an average age of 58±18.5 years. Pre-transplant weight was 72.5 (±5.8) kg, and at 12 months, it was 75.10 (±15.7) kg. Differences were found between first-time and repeat transplants (p=0.020). In the analysis of repeated measures of weight (p=0.022), differences were observed between month 0 and the third month, month 0 and one year, and between the third month and one year.
In muscle mass (p<0.001), differences were seen when comparing month 0 with the third, sixth, and twelfth months. Fat mass differed when comparing the third month with the twelfth month, and visceral fat (p=0.032) differed when comparing the third month with the sixth and twelfth months.
Conclusion: After a kidney transplant, weight gain occurs, especially after the sixth month, reaching 5% per year. Muscle mass increases more than fat mass. People who received kidneys from living donors, those with previous transplants, and those with hypertension and/or cardiovascular disease experience greater weight gain.
Key words: kidney transplant; body composition; overweight; obesity; cardiometabolic risk factors.
INTRODUCCIÓN
La ganancia de peso es un hecho frecuente en las personas trasplantadas renales. La prevalencia de obesidad antes del trasplante oscila entre el 10% y el 19%1-3, estando en cifras similares a la población general, afectando en el postrasplante al 36 % de los pacientes4. En una revisión sistemática publicada en 2016, los hallazgos sugieren que la obesidad tiene un efecto protector para todas las causas de muerte en los pacientes en prediálisis y hemodiálisis (HD), pero no en los receptores de trasplantes5.
La fase postrasplante es un período de ansiedad e inquietud que oscila entre la esperanza y la incertidumbre, la independencia y la dependencia, en ella resulta de especial trascendencia la adopción de hábitos de vida saludables, para la minimización de los factores de riesgo cardiovascular modificables, como la hipertensión arterial (HTA), la diabetes mellitus (DM), el abandono del hábito tabáquico, el sedentarismo y la obesidad6-8.
Con el fin de evitar el rechazo, la mayoría de los receptores tienen que tomar medicación que inhiben su respuesta inmunitaria (terapia inmunosupresora). Aunque el tratamiento ayuda a prevenir el rechazo al órgano, estos medicamentos pueden causar hipertensión, hipercolesterolemia e incrementar el riesgo de desarrollar diabetes, algo similar pasaría con el uso de esteroides sobre todo en los primeros meses del trasplante, debidos a sus efectos metabólicos, redistribución de grasa corporal, retención de agua , y al aumento del apetito del paciente9. Tras el trasplante mejora el estado anoréxico, hipercatabólico y psicológico del paciente, el paciente pasa de una dieta extremadamente restringida a una variada, sintiendo un mayor bienestar, siendo en ocasiones difícil controlar la alimentación y el peso.
La mayoría de los estudios realizados en personas trasplantadas renales han demostrado que la obesidad se asocia a una menor supervivencia del injerto y del paciente, incluso con el riñón funcionante10-12. Sin embargo, la obesidad es heterogénea. Algunos obesos son metabólicamente sanos, mientras que otros con similar peso presentan comorbilidades metabólicas. Para medir la adiposidad total se maneja el índice de masa corporal (IMC), por su simplicidad es utilizado en estudios epidemiológicos y, como medida inicial, para evaluar la obesidad. Sin embargo, tiene limitaciones puesto que no identifica correctamente el exceso de grasa corporal, por su incapacidad para diferenciar la masa magra y grasa, además, no tiene en cuenta factores como la edad, sexo, etnia, etc13…
El conocimiento de la composición corporal por métodos más exactos que las medidas antropométricas habitualmente utilizadas, puede ser un apoyo a las decisiones terapéuticas de reorientación de los estilos de vida, con una dieta equilibrada y variada, la práctica regular de actividad física y la adecuación del tratamiento inmunosupresor a cada etapa de la evolución del trasplante renal, que consigan disminuir la morbimortalidad cardiovascular de los pacientes trasplantados renales sin comprometer la funcionalidad del injerto.
OBJETIVO GENERAL
Medir y evaluar la modificación de la composición corporal (masa magra, masa grasa, agua corporal) postrasplante.
Objetivos específicos
Conocer la ganancia de peso postrasplante.
Determinar si existe relación entre la ganancia de peso y las comorbilidades existentes como la HTA, la DM y dislipemia.
MATERIAL Y MÉTODO
Diseño, población y muestra
Se ha llevado a cabo un estudio observacional descriptivo longitudinal prospectivo en en receptores de injerto renal mayores de 18 años, realizado en el Hospital Universitario Miguel Servet (HUMS), hospital de referencia en Aragón para la realización de trasplante renal.
Población y muestra de estudio: se incluyeron a todas las personas que recibieron un trasplante renal entre el 1 de septiembre de 2020 y el 30 abril de 2022.
Criterios de inclusión: pacientes trasplantados en el período indicado, que fueron informados y dieron su consentimiento para participar en el proyecto por escrito.
Criterios de exclusión: personas que manifiesten su deseo de no participar, personas con amputación de miembros superiores y/o inferiores.
Variables de estudio e instrumentos de medida: Las variables sociodemográficas incluyeron la edad y el sexo de los participantes, las variables clínicas incluyeron medidas antropométricas (altura y peso), comorbilidades de interés (antecedentes de hipertensión, diabetes, dislipemia, enfermedad cardiovascular, enfermedad respiratoria o accidente cerebrovascular), hábitos tóxicos (alcohol y tabaco), tiempo de espera hasta el trasplante, tipo de terapia renal sustitutiva pre-trasplante (sin diálisis, diálisis peritoneal o hemodiálisis) se obtuvieron de la historia clínica electrónica de los pacientes.
Se utilizó como herramienta de medida corporal la báscula de precisión Tanita® BC-601F, mediante la cual se realizaron lecturas segmentales (tronco y cada pierna y brazo por separado). La resistencia eléctrica mide 5 veces en diferentes partes del cuerpo (del pie al pie, de la mano a la mano, de la mano izquierda al pie derecho, de la mano derecha al pie izquierdo y de la mano izquierda al pie izquierdo). Su tecnología permite cubrir el 100% de la superficie corporal mientras las otras básculas similares sólo un 75%, lo que permite una mayor precisión, sobre todo para personas cuya constitución corporal es diferente del modelo estándar, como son las personas trasplantas renales.
Las variables relativas a la medición corporal utilizadas en el estudio fueron el peso en kilogramos, porcentajes de masa muscular, grasa corporal, grasa visceral, agua corporal e IMC total y categorizado en bajo peso, normopeso, sobrepeso y obesidad, (según la OMS), las cuales fueron exportadas a archivo formato Excel, (se excluyeron las variables relacionadas a las extremidades superiores e inferiores, masa ósea, edad metabólica). Previo a cada medición de peso se introdujeron en la báscula la edad, sexo, altura y talla de cada participante.
La recogida de datos se realizó del 1 septiembre de 2020 a 30 de abril de 2023, las mediciones del peso se realizaron en las revisiones establecidas a los 7 días del alta (mes 0), 3er mes, 6º mes y 12º mes del trasplante, en la consulta de enfermería de consultas externas del HUMS.
Análisis estadístico
Para el análisis descriptivo, se presentan los resultados de las variables cualitativas según la distribución de frecuencias absolutas y relativas (n, %), mientras que las variables cuantitativas se presentan mediante medidas de tendencia central y de dispersión (media y desviación estándar para aquellas que siguen distribución normal y mediana y rango intercuartílico para aquellas con distribución no-normal).
El análisis inferencial se realizó mediante comparación de proporciones cuando ambas variables fueron cualitativas (prueba de Χ2 y prueba exacta de Fisher) y comparaciones de medias o de rangos en caso de variables cuantitativas, utilizándose pruebas paramétricas (t de Student, t de Student para muestras relacionadas, ANOVA, Anova de Medidas repetidas) en caso de distribución normal, y no paramétricas (U de Mann-Whitney o Kruskall-Wallis, W de Wilconxon), en caso de distribución no normal. Las diferencias se considerarán estadísticamente significativas para p<0,05 con un intervalo de confianza (IC) del 95%. Para el análisis de los datos se utilizará el paquete estadístico SPSS Statistics Versión 25.
Aspectos éticos
Previamente a la recogida de datos de las historias clínicas, se informó sobre la finalidad de la investigación y se recogió el consentimiento de los participantes que accedieron a participar en el estudio. Se han tenido en cuenta los aspectos éticos y legales vigentes, relacionados con el manejo y uso de información obtenida en el campo de la investigación biomédica, y de acuerdo con el Reglamento (UE) 2018/1725 del Parlamento Europeo y del Consejo, de 23 de octubre de 201814, así como a la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales15. .Asimismo, el estudio se llevó a cabo de acuerdo con la Declaración de Helsinki (World Medical Association, 2013), omitiendo de la explotación de los datos los nombres de los pacientes, sus iniciales, ni los números de historia clínica o cualesquiera que les hayan sido asignados en el hospital. La realización del trabajo fue autorizada por la dirección del hospital y cuenta con la autorización del Comité de Ética de la Investigación de la Comunidad Autónoma de Aragón.
RESULTADOS
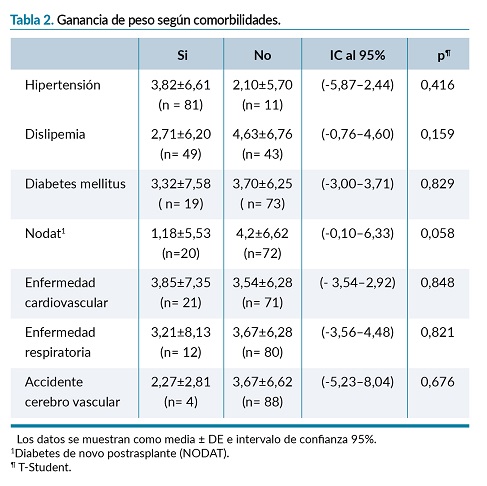
Se analizaron 92 pacientes, un 68,5% varones, edad media 58 (±18,5) años, el 32,6% era mayor de 65 años (n=30). Las principales causas de enfermedad renal crónica fueron las glomerulopatías (30,4%), no filiada (18,5%), tubulointersticial (13%) y diabetes mellitus (12%). El 90,2% fue procedente de donante cadáver, para el 12,0 % no era el primer trasplante. Como acceso vascular un 43,5% tenía una fístula arteriovenosa funcionante y un 19,6 % catéter. El 63% recibía TRS mediante hemodiálisis (HD), 29,3% diálisis peritoneal (DP) y un 7,6 % se encontraba en situación de prediálisis. El 36% presentaba sobrepeso y 14,1% obesidad. Se encontraron diferencias entre el sobrepeso y sexo (p=0,003) e IMC y sexo (p=0,006), así como en el tiempo de permanencia en lista de espera y la edad (p=0,011). (tabla 1).
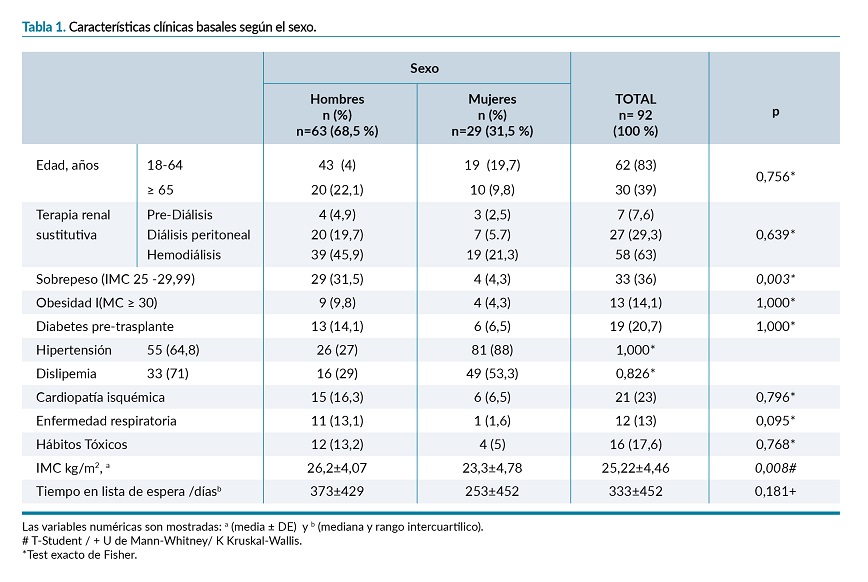
La ganancia global de peso fue de 3,62±6,50 kg, (diferencia de peso de los 0 a los 12 meses). Los valores mínimos y máximos fueron -12,7 y 22,1kg respectivamente. La ganancia de peso a los 12 meses fue menor del 15%.
No se encontraron diferencias en la ganancia de peso (GP) por sexo, grupos de edad, siendo mayor en las personas trasplantadas de donante vivo (tabla 2). La GP fue mayor en aquellas personas con trasplante/s previo/s. (p=0,020), (figura 1).
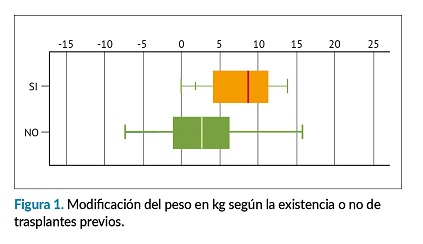
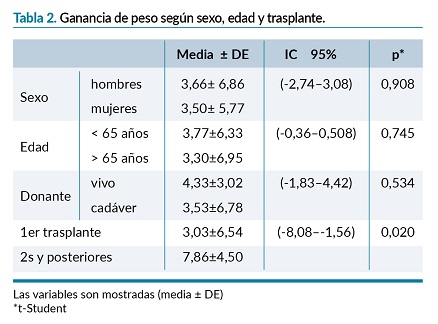
Al comparar la GP con las comorbilidades existentes previas al trasplante, la GP fue mayor en personas hipertensas (3,82±6,61) vs no hipertensas (2,10±5,70) kg, y aquellas con enfermedad cardiovascular previa vs sin ella, por otro lado, fue menor en personas con dislipemia vs sin ella, y aquellas que presentaron Nodat (New Onset Diabetes After Transplantation) de (1,18±5,53) kg, los resultados no mostraron diferencias estadísticamente significativas. (tabla 3).
En la tabla 4 se muestran los valores totales de peso en cada período de seguimiento comparados por sexo, edad, TRS y la composición corporal, (masa muscular, grasa corporal, agua corporal).
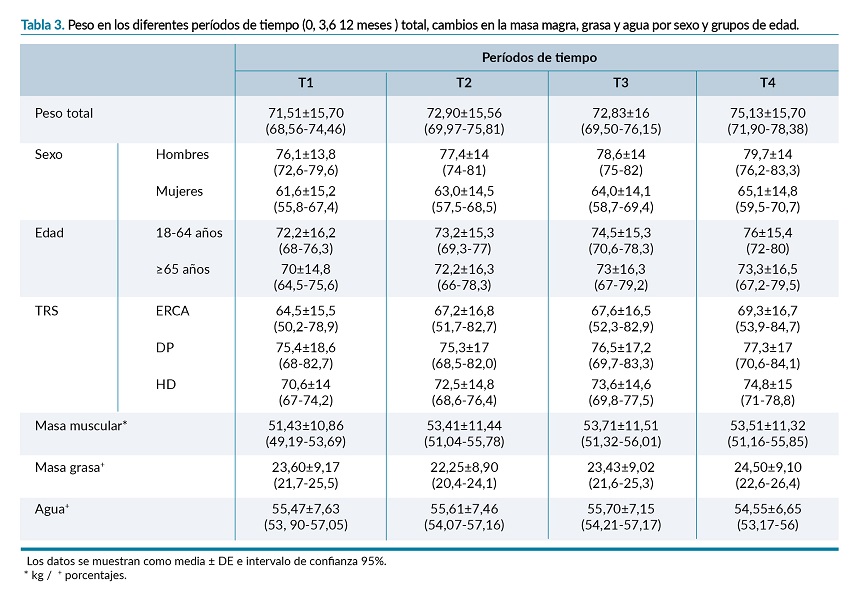
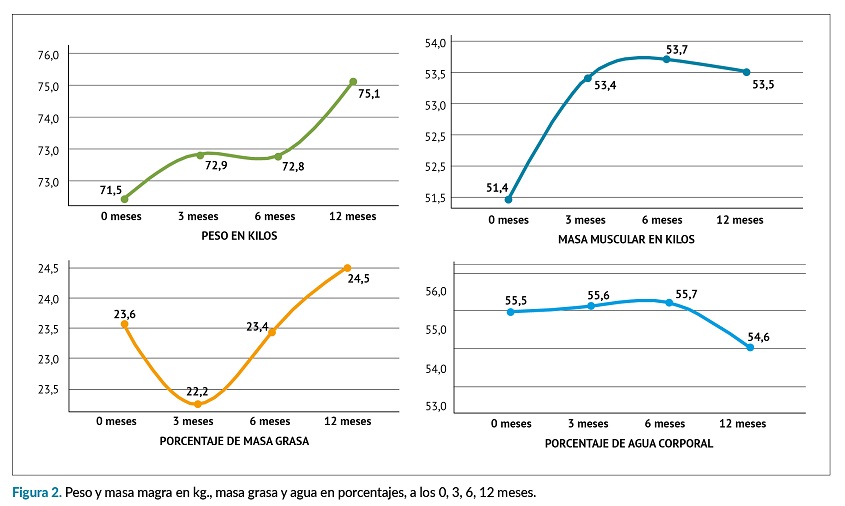
Al analizar las distintas mediciones de peso a los 0, 3, 6 y 12 meses, (T1, T2, T3 y T4,) (Anova de Medidas repetidas), tras comprobar el cumplimiento de normalidad y esfericidad, se hallaron diferencias estadísticamente significativas (p= 0,022). En las comparaciones múltiples por parejas (Bonferroni) las diferencias se mostraron entre T1 y T2, T1 y T4, T2 y T4, siendo los valores de peso en T1 (M=71,51- DE=15,70) menores que T2 (M=72,80- DE=15,56, p= 0,042 [IC 95%: -2,72; -0,03]) y menores que T4 (M=75,13±15,70, p<0,001 [IC 95%: -5,44; -1,78)], Así mismo, los resultados en T2 fueron menores que en T4, p<0,001 [IC 95%: -3,59; -0,89], (figura 2).
Al comparar las mediciones del peso en los diferentes periodos de tiempo con el sexo, no se encontraron diferencias estadísticamente significativas (p=0,383), sin embargo, se mostraron diferencias en la comparación entre T1 y T2 (p= 0,044, [IC 95%: -2,72; -0,024]), T1 y T4 (p<0,001, [IC 95%: -5,45; -1,77]), entre T2 y T4 (p<0,001, [IC 95%: -3,60; -0,88].
Lo mismo sucedió al comparar el peso con la TRS (p=0,113) y con los grupos de edad (p=0,421).
Las diferencias por TRS se dieron entre T1 y T2, (p=0,042, [IC 95%: -2,72; -0,032]), T1 y T4 (p<0,001, [IC 95%: -5,44; -1,79]) y, entre T2 y T4 (p<0,001, [IC 95%: -3,59; -0,90].
Por grupos de edad se mostraron diferencias entre las parejas T1 y T2 (p=0,042, [IC 95%: -2,71; -0,033]), T1 y T4 (p<0,001, [IC 95%: -5,45; -1,77]) y entre T2 y T4 (p<0,001, [IC 95%: -3,58; -0,90]).
Al comparar el peso de los diferentes períodos de tiempo con la existencia previa de hipertensión, diabetes, dislipemia, enfermedad cardiovascular, enfermedad respiratoria y desarrollo de Nodat post-trasplante, no se encontraron diferencias estadísticamente significativas, no obstante, en la comparación múltiple por parejas se mostraron diferencias entre T1 y T2, T1 y T4, T2 y T4 en todas ellas.
El IMC fue menor en T1: 24,84±4,45 (mín. 14-máx. 37) que en T4: 26,17±4,63 (mín. 16,2-máx. 38,1), (p<0,001), las diferencias se encontraron entre T1 y T3, (p<0,001), T1 y T4 (p<0,001), T2 y T3 (p=0,006), T2 y T4 (p<0,001), T3 y T4 (p=0,007). El sobrepeso paso del 36% en T1 al 39,13% en T4, la obesidad del 9,78% en T1 al 18% en T4, siendo el aumento mayor del 5%. Al comparar el IMC pre-trasplante con el de los 12 meses el aumento no superó el 5%.
En las mediciones de masa muscular, se encontraron diferencias significativas entre los diferentes tiempos, (p=0,001), F(2,70)=12,33, (n2=0,119) y β-1=0,99, siendo los valores de masa muscular menores en T1 al compararlos con T2, (p=0,001 [IC 95%: -3,28; -0,67]), con T3, (p<0,001 [IC 95%: -3,53; -1,00]) y con T4, (p<0,001 [IC 95%: -3,36; -0,78]).
Respecto a la masa grasa los valores obtenidos, (p=0,003), F(2,70)=5,14, (n2=0,054) y β-1=0,90, fueron menores en T2 (M=22,25, DE=8,90), p<0,001, que en T4 (M=24,50, DE=9,10 [IC 95%: -3,65; -0,84]).
Los resultados de grasa visceral (p=0,032), la grasa visceral fue menor en T2 (M=9,14, DE=4,43), que en T4 (M=9,76, DE=4,52), p=0,037, [IC 95%: -1,216; -0,023], y que en T3 (M=9,22, DE=4,64) menor que T4, p=0,022, [IC 95%: -0,050; 1,026].
La composición de agua corporal total (ACT), no mostró diferencias estadísticamente significativas (p=0,141), siendo los valores de T4 fueron menores (M=54,55, DE=6,65), que en T3 (M=55,70, DE=7,15), p=0,020, [IC 95%: 0,121; -2,161].
DISCUSIÓN
Existen numerosos estudios que describen un aumento de peso después de recibir un trasplante renal, la literatura describe un aumento en torno al 10-15%16. Los resultados obtenidos en el estudio muestran una ganancia de peso de 3,62 ± 6,50 kg, lo que supone un aumento del 5,07% del peso a los 12 meses. En nuestro país diversos estudios encuentran una ganancia de peso de 6,6 kg al año y siendo este aumento del 8%17. En otros estudios la ganancia fue del 10,9% durante el primer año. Los resultados de ganancia de peso fueron mayores en hombres que en mujeres, estas diferencias también se han documentado en estudios previos, siendo en otros estudios la ganancia mayor en mujeres11,18.
La evolución del peso en los periodos de seguimiento mostro una tendencia ascendente desde el alta a los 3 meses, mantenida entre los 3 meses y los 6 meses, elevándose de nuevo de los 6 a los 12 meses. Esto se muestra en un aumento del sobrepeso del 36% al 39% y de la obesidad del 14,1% al 19,6% al año. La prevalencia de obesidad antes del trasplante oscila entre el 10% y el 19%1-3, valores similares a los de población general.
Según Kwan2, los obesos clase I, II y III pasaron del 16% al 31%, del 14% al 35% y del 17% al 32%, respectivamente. Hoogeveen et al. estudiaron 1.810 trasplantados durante un período de 13 años, durante el cual la proporción de pacientes obesos pre-trasplante fue 5,6% aumentando al 11,5% postrasplante19.
Para determinar la evolución del peso, la existencia de sobrepeso y obesidad, la mayoría de los estudios utilizan el IMC, como se comentó anteriormente es un índice que tiene ciertas limitaciones, al no diferenciar entre los distintos elementos que incluyen la composición corporal, (masa grasa y magra, agua, hueso), además no tiene en cuenta factores como la edad y el sexo, entre otros13.
Es por ello, que existen escasas publicaciones en las que se determine los cambios que se producen en la composición corporal tras recibir un trasplante renal, la mayoría de los estudios utilizan la bioimpedancia para medir estos cambios. El análisis BIA (BIA) mide la resistencia a la corriente, a medida que ésta viaja a través del músculo y la grasa. Cuanto mayor contenido de músculo tenga una persona, más agua almacena el cuerpo. Cuanta mayor contenido de agua tenga el cuerpo, la corriente eléctrica pasa con más facilidad. Los niveles altos de grasa provocan resistencia al paso de la corriente. El tejido graso contiene de 10% a 20% de agua, mientras que la masa magra (que incluye al músculo, hueso y el agua ubicada fuera de los músculos) contiene un promedio de 70% a 75% de agua.
La masa muscular total expresó valores al alta de 51,4±11, siendo a los 12 meses de 53,51±15,70 kg., reflejado en una tendencia al alza en los 3 primeros meses, manteniéndose estable en los siguientes períodos, estas cifras son menores a lo encontrado en otro estudio (57,9±16,6) realizado en nuestro país en trasplantados renales prevalentes, sin seriación de la composición corporal20. Al compararlo con una cohorte de pacientes asiáticos, con igual seriación de tiempo, la masa muscular disminuyó después del trasplante y luego los pacientes recuperaron masa muscular lentamente21.
Las personas trasplantadas renales tienen mayor cantidad de tejido graso que la población general, aspecto que se mantiene en los resultados de nuestro estudio, expresando un descenso a los 3 meses, elevándose en los siguientes períodos de seguimiento, siendo valores menores a lo encontrado en otro estudio realizado en nuestro país 20. Según Han, los resultados mostraron un aumento de la masa grasa continuo después del trasplante21. Este hecho reproduce lo observado por otros autores que evalúan la evolución de la masa grasa medida por bioimpedancia a lo largo del primer año postrasplante. Sin que parezca verse influenciada por la dosis de esteroides recibida, ni el tratamiento con anticalcineurínicos ni micofenolato, disminuyendo la misma en tratamiento con everolimus o azatioprina20. La grasa visceral también mostro un ligero aumento continuado, siendo este tipo de grasa la que puede comprometer la viabilidad del injerto.
Una hidratación adecuada, es sumamente importante para la salud y el bienestar, los resultados hallados en la composición de agua corporal total muestran valores del 53-57%, siendo el óptimo en población general del 55-60%, se encontró una pequeña disminución del ACT a los 12 meses, es conocido que una pérdida de agua corporal puede afectar de forma negativa al músculo23, no afectando en nuestro estudio a la masa muscular, a su vez, se observó una tendencia a la inversa entre la masa grasa y el estado de volumen en el presente estudio.
A fecha de finalización del estudio 89 personas mantenían una función renal adecuada, con injertos funcionantes, 3 personas fallecieron por distintas causas no relacionadas con el trasplante renal.
La finalidad de estudio es conocer los cambios que se producen en la composición corporal tras un trasplante renal, por métodos más precisos que las medidas antropométricas habitualmente utilizadas, una vez que el riñón posee todas sus funciones restablecidas.
En este sentido, identificar y valorar aquellos factores de riesgo que puedan perjudicar la salud de las personas es una de las funciones de los profesionales de enfermería, la promoción de hábitos saludables evitando el sedentarismo y la obesidad pueden ayudar a mantener un peso adecuado después de un trasplante renal.
Limitaciones del estudio
Una de las limitaciones de este trabajo es el hecho de no incluir la medicación inmunosupresora, ni registrarse los cambios en el tratamiento. Tampoco se han tenido en cuenta las posibles dificultades durante el postoperatorio una vez obtenida el alta hospitalaria, ni datos relacionados con la calidad de vida antes y después del trasplante, por exceder los objetivos de este estudio.
A partir de los resultados observados podemos concluir que tras el trasplante renal se produce un ligero incremento de peso en los 3 primeros meses, siendo a partir del sexto mes cuando se produce el mayor aumento de este, situándose en aproximadamente un 5% sobre el peso inicial tras el primer año. Este incremento de peso se ve reflejado especialmente en un aumento de la masa muscular, aunque también aumenta la masa grasa. Las personas con trasplante de donante vivo, las que han recibido un trasplante previo, así como las que tienen HTA y/o enfermedad cardiovascular son las que presentan una mayor ganancia peso.
Agradecimientos
A Raúl López y Concepción Herrando por su colaboración en la recogida de datos, así como, a Daniel Bordonaba, por la ayuda brindada en el asesoramiento estadístico para la realización de este proyecto.
Conflicto de interés
Los autores declaran no tener ningún conflicto de interés.
Financiación
Los autores declaran no haber recibido financiación alguna.
BIBLIOGRAFÍA
1. López Garrigós P, Rojas Guadamilla I, González Calero A, Mas Agrafojo C, Gálvez Velasco A, Vargas Ramírez P, et al. Evolución del peso en pacientes durante el primer año del trasplante renal. Enfermería Nefrológica 2014;17(3):209-15.
2. Kwan JM, et al. Effect of the obesity epidemic on kidney transplantation: obesity is independent of diabetes as a risk factor for adverse renal transplant outcomes. PloS one 11.11 (2016): e0165712.
3. Erturk T, Berber I, & Cakİr U. Effect of obesity on clinical outcomes of kidney transplant patients. In Transplantation Proceedings. Elsevier 2019;51(4):1093-5.
4. Cofán F, Vela E, Clèries M. Obesity in Renal Transplantation: Analysis of 2691 Patients. Transplant Proc [Internet]. 2005 Nov 1 [consultado 7 Jun 2023];37(9):3695-7. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0041134505012212.
5. Ladhani M, Craig JC, Irving M, Clayton PA, Wong G. Obesity and the risk of cardiovascular and all-cause mortality in chronic kidney disease: A systematic review and meta-analysis. Nephrol Dial Transplant 2017;32(3):439-49.
6. Halonen JI, Kivimäki M, Pentti J, Kawachi I, Virtanen M, Martikainen P, et al. Quantifying Neighbourhood Socioeconomic Effects in Clustering of Behaviour-Related Risk Factors: A Multilevel Analysis. Vermund SH, editor. PLoS One [Internet]. 2012 [consultado 7 Jun 2023];7(3):e32937. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3299718/.
7. Moreso F, Hernández D. Has the survival of the graft improved after renal transplantation in the era of modern immunosuppression? Nefrologia 2013;33(1):14–26.
8. Lendraitiene E, Lanevskaite E, Petrusevicienė D, Berskienė K, Lendraitis V. Effect of Different Physical Therapy Programs on Renal Transplant Recipients’ Physical Activity, Grip Strength, and Psychoemotional Status and the Associations Between These Indice Transplant Proc. 2018;50(10):3338–45.
9. Borroto Díaz G, Quintanilla Andino M, Barceló Acosta M, Lisandra Cabrera Valdés L. Ganancia de peso, dismetabolia y función renal al año del trasplante renal. Revista Cubana de Alimentación y Nutrición 2012;22(2):186-202.
10. Shirali AC, Bia MJ. Management of cardiovascular disease in renal transplant recipients. Clin J Am Soc Nephrol 2008;3(2):491–504.
11. Wang K, Liu Q-Z. Effect analysis of 1-year posttransplant body mass index on chronic allograft nephropathy in renal recipients. Transplant Proc 2011;43(7):2592-5.
12. Nicoletto BB, Fonseca NK, Manfro RC, Gonçalves LF, Bauermann Leitão C, Souza GC. Effects of obesity on kidney transplantation outcomes: a systematic review and meta-analysis. Transplantation 2014;98(2):167-76.
13. Segura-Fragoso A, Rodríguez-Padial L. Alonso-Moreno FJ, Villarín-Castro A, Rojas-Martelo GA, Rodríguez-Roca GC, et al. Medidas antropométricas de obesidad general y central y capacidad discriminativa sobre el riesgo cardiovascular: estudio RICARTO. Medicina de Familia. Semergen 2019;45(5):323-32.
14. Reglamento (UE) 2018/1725 del Parlamento Europeo y del Consejo, de 23 de octubre de 2018, relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales por las instituciones, órganos y organismos de la Unión y a la libre circulación de estos datos y por el que se deroga el Reglamento (CE) nº 45/2001 y la Decisión nº 1247/2002/CE (Texto pertinente a efectos del EEE). [Internet]. Diario Oficial de la Unión Europea. Parlamento Europeo, Consejo de la Unión Europea; Estrasburgo. 2018. [consultado 30 ago 2023]. Disponible en: https://eur-lex.europa.eu/eli/reg/2018/1725/oj.
15. Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales. Boletín Oficial del Estado, número 294, (6 de diciembre de 2018). [acceso 31 Ago 2023]. Disponible en: https://www.boe.es/eli/es/lo/2018/12/05/3.
16. Vega J, Huidobro JP, De La Barra S, Haro D. Influencia de la ganancia de peso durante el primer año del trasplante renal en la sobrevida de injertos y pacientes. Rev Med Chile 2015;143(8):961-70.
17. Bach Pascual A, Martínez Sáez A, Martínez Delgado Y, Sobrado Sobrado O, Redondo Pachón MD, Junyent Iglesias E. Obesidad, diabetes y trasplante. Enfermería Nefrológica 2017;20(1):82-7.
18. Fernández Castillo R, Fernández Gallegos R, Esteban de la Rosa RJ, Peña Amaro M. Estudio longitudinal del peso e índice de masa corporal tras el trasplante renal durante 5 años de evolución. Nutr. Hosp. [Internet]. 2014 [consultado 19 Jul 2023];30(2):287-92. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0212-16112014000900009&lng=es.
19. Hoogeveen EK, Aalten J, Rothman KJ, Roodnat JI, Mallat MJK, Borm G, et al. Effect of obesity on the outcome of kidney transplantation: A 20-year follow-up. Transplantation 2011;91:869–74.
20. Panizo González, N. Análisis de la composición corporal por bioimpedancia espectroscópica en pacientes trasplantados renales. Factores relacionados con la sobrehidratación y el exceso de masa grasa e impacto clínico de los mismos. [Tesis doctoral]. Madrid: Universidad Complutense de Madrid; 2016. [consultado 19 Jul 2023]. Disponible en: https://produccioncientifica.ucm.es/documentos/5d1df61e29995204f7661dfe.
21. Han SS, Hwang JH, Oh YJ, Cha RH, Ahn C, Kim YS. Change in Body Compositions of Asian Recipients after Kidney Transplantation. J Korean Med Sci 2012;27(10):1182-7.
22. Souza GC, Costa C, Scalco R, Goncalves LF, Manfro RC: Serum leptin, insulin resistance, and body fat after renal transplantation. J Ren Nutr 2008;18:479-88.
23. Gigou P-Y, Lamontagne-Lacasse M, Goulet EDB. Meta-analysis of the effects of pre-exercise hypohydration on endurance performance, lactate threshold and VO2max. Med Sci Sports Exerc 2010;42(5):361-2. DOI: 10.1249/01.MSS.0000384636.37362.40.
Este artículo se distribuye bajo una Licencia Creative Commons Atribución–NoComercial 4.0 Internacional.
https://creativecommons.org/licenses/by-nc/4.0/
