Eficacia del apósito de gluconato de clorhexidina sobre las infecciones relacionadas con el catéter de hemodiálisis
Raquel Pelayo-Alonso1, Mirian García-Martínez2, Patricia Martínez-Álvarez2, Marta Portilla-Sánchez2, Sandra Pacheco-Martínez2, José Luis Cobo-Sánchez1,3
1 Área de Calidad, Formación, Investigación, Desarrollo e Innovación en Enfermería. Hospital Universitario Marqués de Valdecilla. IDIVAL. Santander. España
2 Unidad Clínica Nefrología. Unidad de Hemodiálisis. Hospital Universitario Marqués de Valdecilla. Santander. España
3 Escuela Universitaria de Enfermería Hospital Mompía. Universidad Católica de Ávila. Mompía. España
https://doi.org/10.37551/S2254-28842023022
Como citar este artículo:
Pelayo-Alonso R, García-Martínez M, Martínez-Álvarez P, Portilla-Sánchez M, Pacheco-Martínez S, Cobo-Sánchez JL.
Eficacia del apósito de gluconato de clorhexidina sobre las infecciones relacionadas con el catéter de hemodiálisis.
Enferm Nefrol 2023;26(3):232-9
Correspondencia:
|
Recepción: 30-07-2023
|
RESUMEN
Introducción: El uso de catéteres venosos centrales para hemodiálisis se relaciona con un mayor desarrollo de complicaciones infecciosas, por lo que las Guías de Práctica Clínica recomiendan diferentes estrategias para disminuir dichas complicaciones, sin indicación clara sobre el apósito a utilizar en la cura del orificio de salida.
Objetivos: Comparar la tasa de infecciones relacionadas con el catéter de dos pautas de cura del orificio de salida del catéter venoso central de hemodiálisis: apósito con gluconato de clorhexidina al 2% frente a clorhexidina en solución al 2%, cubierta con apósito de poliuretano semipermeable autoadhesivo.
Material y Método: Estudio experimental, controlado, aleatorizado en pacientes en hemodiálisis a través de catéter venoso central para comparar dos pautas de cura, grupo control: clorhexidina en solución al 2% cubierta con apósito de poliuretano semipermeable autoadhesivo y grupo intervención: apósito con gluconato de clorhexidina al 2%. Se recogieron datos socioclínicos y relacionados con las complicaciones infecciosas. Se realizó un análisis descriptivo e inferencial..
Resultados: Se estudiaron 50 pacientes, 25 en cada grupo. El grupo intervención presentó dos infecciones del orificio de salida y el grupo control, presentó doce casos (OR: 0,176, IC 95%: 0,039-0,790; p=0,013). El grupo intervención presentó un caso de bacteriemia frente a dos episodios del grupo control (OR: 0,533, IC 95%: 0,048-5,892; p=ns).
Conclusión: La cura con apósito con gluconato de clorhexidina al 2% es una medida protectora frente a la infección del orificio de salida en comparación con la cura con clorhexidina en solución al 2% y apósito de poliuretano.
Palabras clave: catéteres venosos centrales; hemodiálisis; bacteriemia; infecciones relacionadas con catéteres; clorhexidina; apósitos.
ABSTRACT
Efficacy of Chlorhexidine Gluconate Dressing on Catheter-Related Infections in Hemodialysis
Introduction: The use of central venous catheters for hemodialysis is associated with a higher incidence of infectious complications, leading Clinical Practice Guidelines to recommend various strategies to reduce such complications, with no clear indication of the dressing to use for catheter exit site care.
Objectives: To compare the infection rate related to the catheter exit site using two different protocols: dressing with 2% chlorhexidine gluconate versus 2% chlorhexidine solution, both covered with self-adhesive semi-permeable polyurethane dressing for central venous catheters used in hemodialysis.
Material and Method: An experimental, controlled, randomized study was conducted in hemodialysis patients with central venous catheters to compare two care protocols. The control group received a 2% chlorhexidine solution covered with a self-adhesive semi-permeable polyurethane dressing, while the intervention group received a dressing with 2% chlorhexidine gluconate. Socio-clinical and infection-related data were collected, and descriptive and inferential analyses were performed.
Results: A total of 50 patients were studied, with 25 in each group. The intervention group had two exit site infections, while the control group had twelve cases (OR: 0.176, 95% CI: 0.039-0.790; p=0.013). The intervention group had one case of bacteremia compared to two cases in the control group (OR: 0.533, 95% CI: 0.048-5.892; p=ns).
Conclusion: Dressing with 2% chlorhexidine gluconate is a protective measure against exit site infection compared to dressing with 2% chlorhexidine solution and polyurethane dressing.
Key words: central venous catheters; hemodialysis; bacteremia; catheter-related infections; chlorhexidine; dressings.
INTRODUCCIÓN
El acceso vascular constituye un elemento fundamental para el paciente en tratamiento renal sustitutivo (TRS) con hemodiálisis1. Pese a las recomendaciones de las Guías de Práctica Clínica sobre accesos vasculares para HD2,3 en las que se aconseja el uso de fístulas arteriovenosas (nativas o protésicas), los catéteres venosos centrales (CVC) son una alternativa muy frecuente en las unidades de hemodiálisis por diversos motivos: falta de planificación, posibilidad de disponer de un acceso vascular en pacientes con un lecho vascular agotado, disponibilidad inmediata ante una situación de urgencia, etc4.
Según últimos datos publicados correspondientes al año 2020, aproximadamente el 70% de los pacientes que inician tratamiento con HD en EEUU5 lo hacen a través de un CVC, y en España, un 40%, según datos del registro catalán6. Cuando se valoran los datos de prevalencia, las cifras disminuyen hasta el 24% en EEUU y al 36% en el registro español. Estas cifras se sitúan muy lejos de la recomendación de la Guía Clínica Española del Acceso Vascular para Hemodiálisis, de una tasa de catéteres inferior al 10%1.
El uso del CVC como acceso vascular para HD (CVC-HD) se relaciona con una mayor morbilidad, mortalidad, tasas de hospitalización y coste sanitario asociados debido a un mayor desarrollo de complicaciones, especialmente, infecciosas7,8. Los pacientes en hemodiálisis que se dializan a través de un CVC presentan tasas más altas de bacteriemia relacionada con el catéter (BRC)9, hasta 10 veces más alta que los pacientes que se dializan a través de fístula arteriovenosa1. La incidencia de BRC para los CVC-HD tunelizados es muy variable según la literatura, con cifras que oscilan desde 0,5 a 7,8 episodios por 1.000 días-catéter10, 11, al igual que la incidencia de infección del orificio de salida (OS), oscilando entre 1,8 y 5,6 episodios por 1.000 días-catéter12,13. Dicha variabilidad puede deberse a las diferencias de definición tanto de bacteriemia como de infección del OS. Pero lo que sí refleja, es la heterogeneidad en el manejo clínico de los pacientes y en la adherencia a las guías de práctica clínica.
La Guía Española Multidisciplinar de Acceso Vascular (GEMAV)1 recomienda llevar a cabo una serie de cuidados sobre el OS y piel circundante para controlar el crecimiento bacteriano y evitar la contaminación extraluminal. El OS debe ser inspeccionado en cada sesión de hemodiálisis, la cura se debe limitar a una frecuencia semanal (salvo que esté sucio o despegado) y recomienda usar como antiséptico, clorhexidina en una concentración superior a 0,5%, pero no establece una recomendación clara en cuanto al apósito a utilizar, al igual que la reciente actualización de la guía KDOQII3.
OBJETIVOS
Comparar la tasa de infecciones relacionadas con el catéter (bacteriemia, infección del orificio de salida y tunelitis) de dos pautas de cura del OS del CVC-HD: cura con apósito con gluconato de clorhexidina al 2% autoadhesivo y cura con clorhexidina en solución al 2% y cubierta con apósito de poliuretano semipermeable autoadhesivo.
MATERIAL Y MÉTODO
Se realizó un estudio experimental, controlado y aleatorizado.
Se incluyeron pacientes mayores de 18 años sometidos a hemodiálisis crónica en la Unidad de Hemodiálisis del Hospital Universitario Marqués de Valdecilla de Santander, entre noviembre de 2020 y julio de 2022. El periodo de seguimiento de cada paciente fue de 14 semanas. Como criterios de inclusión se establecieron realizar HD de forma programada en la unidad de estudio y utilizar como acceso vascular, un CVC-HD tunelizado insertado al menos 30 días antes de la inclusión en el estudio. Se excluyeron aquellos pacientes que presentaban alergia o hipersensibilidad a la clorhexidina o al apósito de poliuretano, los que se dializaban a través de un CVC-HD no tunelizado o aquellos que presentaban una infección activa en el momento de la inclusión en el estudio. Además, se establecieron como posibles causas de pérdida de pacientes durante el periodo de seguimiento, la realización de un trasplante renal, punción de fístula arteriovenosa, transferencia a programa de diálisis peritoneal, presentar reacción de hipersensibilidad al gluconato de clorhexidina, salida de programa de hemodiálisis por causas clínicas o exitus del paciente.
Se estimó un tamaño muestral de 50 individuos (25 por rama), teniendo en cuenta una tasa de complicaciones infecciosas del 25% en el grupo control14 y del 5% en el grupo experimental (riesgo alfa 0,05, riesgo beta 0,2, pérdidas esperadas 10%). El cálculo del tamaño muestral se realizó con el programa GRANMO versión 7.12.
Los pacientes se randomizaron a partir de sobres cerrados y numerados que contenían el grupo de cura control o intervención al que podían ser asignados y cuya preparación había sido realizada por una persona ajena al equipo investigador. Los pacientes fueron incluidos de forma consecutiva, tras ser invitados a participar en el estudio por un miembro del equipo investigador y ser informados de los detalles del mismo, de forma oral y por escrito, y una vez otorgado su consentimiento informado. El estudio fue aprobado por el Comité de Ética de la Investigación con medicamentos de Cantabria (CEIm, referencia 2020.352) y registrado en ClinicalTrials.gov NCT05855616.
Las intervenciones a comparar fueron:
- Grupo Control (GC): limpieza del OS con suero salino fisiológico (0,9%), secado con gasas estériles, desinfección con clorhexidina en solución (CS) al 2% en base acuosa, secado ambiental durante dos minutos y cubierta con apósito de poliuretano semipermeable adhesivo.
- Grupo Intervención (GI): limpieza del OS con suero salino fisiológico (0,9%), secado con gasas estériles, aplicación del apósito con gluconato de clorhexidina (AGC) al 2% autoadhesivo, centrando bien la banda de gel de gluconato de clorhexidina en el OS.
La cura del OS se realizó por enfermeras experimentadas de la Unidad de Hemodiálisis, tras realizar sesión informativa sobre la metodología del estudio y el correcto manejo del AGC. En ambos casos, la cura del OS se realizaba con una frecuencia semanal (el primer día de la semana que el paciente acudía a sesión) o si el apósito se encontraba en mal estado, antes de realizar la conexión al catéter. Se utilizaban medidas de asepsia, incluyendo higiene de manos, material y cura estéril y uso de mascarilla tanto el paciente como los profesionales implicados. Todos los CVC-HD disponían de bioconectores. La conexión del monitor de hemodiálisis también se realizó siguiendo los mismos principios de asepsia.
Se recogieron datos clínicos y sociodemográficos del paciente, incluyendo edad, sexo, nefropatía de base según código ERA/EDTA, grado de comorbilidad según el Índice de Comorbilidad de Charlson modificado (ICCm) para pacientes con enfermedad renal, tiempo en TRS con hemodiálisis y datos relacionados con el CVC-HD (diseño, material, días de uso, vena de inserción y antecedentes de infecciones previas relacionadas con el catéter).
Se valoró la aparición de episodios de infecciones relacionadas con el catéter durante el periodo de seguimiento, en base a las siguientes definiciones1,3.
- BRC: definida como el aislamiento de un mismo microorganismo en sangre y CVC en ausencia de otro foco de infección.
- Infección del orificio de salida: cultivo positivo de frotis de pericatéter y/o exudado junto con presencia de signos inflamatorios limitados a 2 cm alrededor del orificio de salida cutáneo, sin extensión superior hacia el manguito del catéter.
- Tunelitis: cultivo positivo de frotis de pericatéter y/o exudado junto con signos inflamatorios que se extienden más allá de 2 cm del orificio de salida cutáneo y en el trayecto subcutáneo del catéter. Puede estar asociada o no a fiebre y bacteriemia, y acompañarse de exudado purulento a través del OS cutáneo.
Ante la sospecha clínica de BRC por fiebre (≥38ºC) se extrajeron 2 tandas de hemocultivos, con 15 minutos de diferencia, para gérmenes aerobios y anaerobios de ambas ramas del catéter1,3.
El OS se inspeccionó en cada sesión-eritema, costra, prurito, dolor o exudado-. Ante la presencia de signos de infección, la enfermera responsable de la sesión del paciente, recogió un cultivo del frotis pericatéter.
Se calculó la densidad de incidencia de complicaciones infecciosas (infección orificio de salida, tunelitis y bacteriemia) relacionadas con el CVC (número de infecciones OS o bacteriemias relacionadas con el catéter venoso tunelizado/días de uso del catéter venoso x 1000)1 tanto para el total de la muestra como por grupos de intervención.
Para la recogida de datos, se creó una base de datos tipo Excel con las variables a estudio, en la que fueron introducidas por un miembro del equipo investigador, recopilando los datos de la historia clínica electrónica del paciente y de los registros de hemodiálisis correspondientes.
Se realizó un análisis descriptivo de las variables a estudio: en el caso de las variables cuantitativas se calcularon medidas de tendencia central y de dispersión adecuadas a la distribución, y en el caso de las variables categóricas, la frecuencia y porcentaje. Para determinar la eficacia de la pauta de cura se calcularon las odds ratio para grupo y complicación infecciosa. En el caso de comparaciones entre variables categóricas se empleó la prueba de chi-cuadrado o la prueba exacta de Fisher. Las variables continuas se compararon utilizando los tests de la T de Student o de la U de Mann Whitney, en función de la distribución de las mismas. Para el estudio de variables asociadas a la presencia de infecciones relacionadas con el catéter se realizó un análisis de regresión logística múltiple que incluyó como variables independientes la edad, el sexo, la etiología de la enfermedad renal, el grado de comorbilidad, el tiempo en TRS con HD, el tipo de catéter, la duración del catéter, la localización y la presencia de infecciones previas relacionadas con el catéter. Los resultados se consideraron significativos si el nivel crítico observado era inferior al 5% (p< 0,05). El análisis estadístico se realizó con el paquete estadístico PSPP.
RESULTADOS
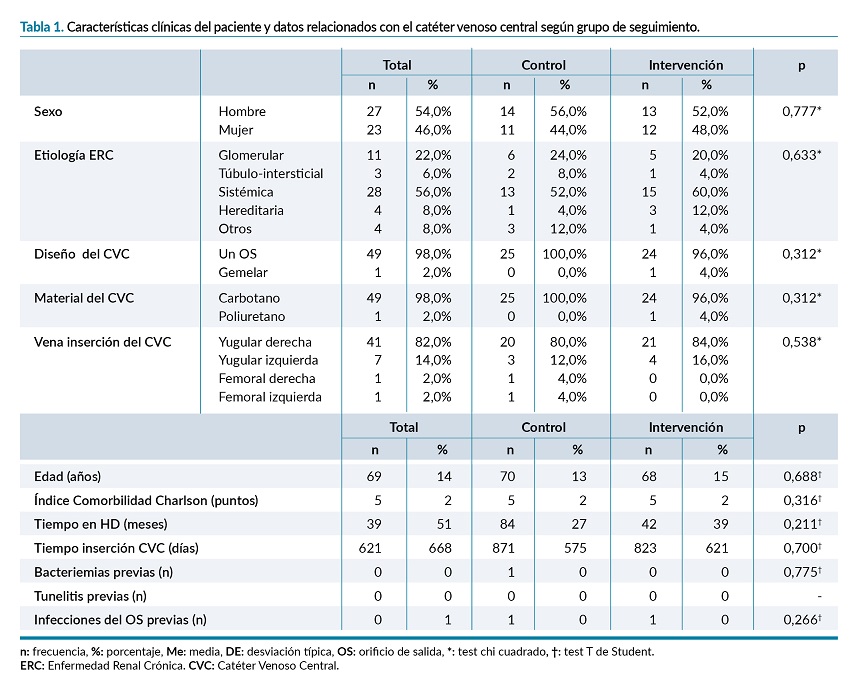
Se incluyeron en el estudio un total de 53 pacientes, de los cuales, tres, no completaron el periodo de seguimiento del mismo (las causas de pérdida fueron trasplante, episodio de reacción de hipersensibilidad al AGC y exitus, respectivamente), por lo que la muestra final fue de 50 pacientes, 25 para cada uno de los grupos (figura 1), siendo el 54% hombres, con una edad media de 68,8±13,9 años. Las características clínicas del paciente y los datos del CVC en función del grupo de estudio, se detallan en la tabla 1. No hubo diferencias estadísticamente significativas entre las características en ambos grupos.
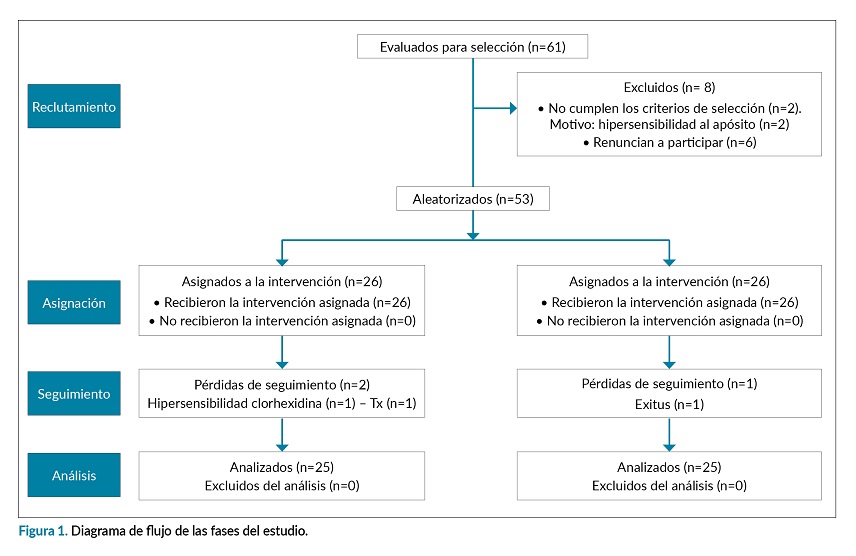
Se analizaron un total de 2.077 sesiones de hemodiálisis, el 51,6% (n=1.073) correspondieron al GC y el 48,3% (n=1.004), al GI.
En la tabla 2 se especifican los diferentes signos de infección valorados en cada sesión de hemodiálisis, así como su frecuencia de aparición y los eventos infecciosos surgidos.
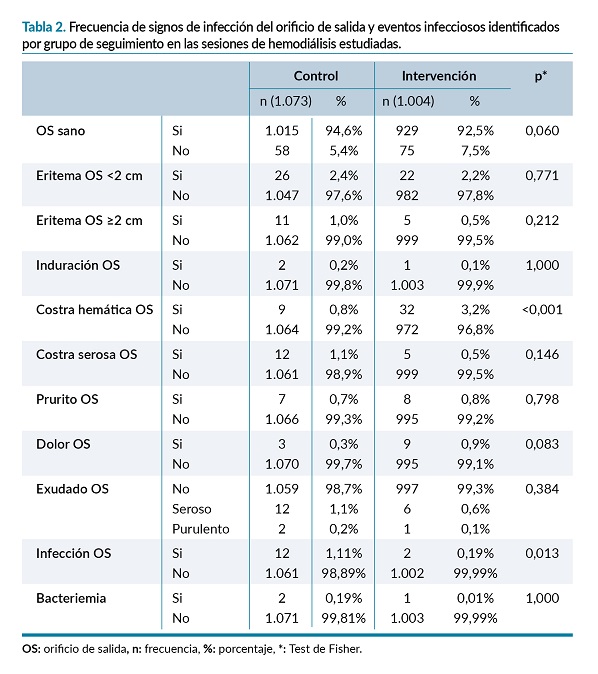
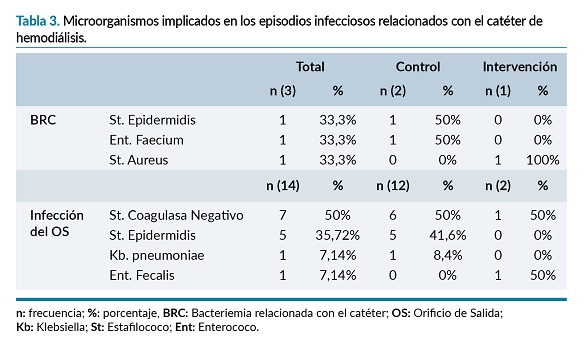
La tasa global de infección del OS fue de 0,395 episodios por 1.000 días-catéter. Analizando por grupos, el GI presentó dos infecciones del OS frente a doce infecciones del OS que se dieron en el GC (OR: 0,176, IC 95%: 0,039-0,790; p=0,013). El grupo control presentó una densidad de incidencia de infección del OS de 0,64 episodios por 1.000 días-catéter frente al grupo intervención que presentó 0,12 episodios por 1.000 días-catéter (p=0,013). El germen más frecuentemente implicado fue el Estafilococo Coagulasa Negativo seguido del Estafilococo Epidermidis (tabla 3).
No hubo ningún episodio de tunelitis durante el periodo de seguimiento en ninguno de los dos grupos.
En cuanto a las BRC, el GI presentó una bacteriemia frente a dos bacteriemias en el GC (OR: 0,533, IC 95%: 0,048-5,892; p=1,00).
El GC presentó una densidad de incidencia de BRC de 0,1 episodios por 1.000 días-catéter frente al GI que presentó 0,06 episodios por 1.000 días-catéter (p= ns). La tasa global de incidencia para la BRC fue de 0,085 episodios por 1.000 días-catéter.
Del total de los 14 episodios de infecciones del OS, solamente 1 caso cursó también con bacteriemia, lo que supone un 0,14%, siendo el germen implicado el Estafilococo Epidermidis.
DISCUSIÓN
Un correcto mantenimiento de los CVC-HD es necesario para garantizar una baja tasa de complicaciones infecciosas relacionadas con el CVC-HD10-12, siendo especialmente importante el cuidado del OS. La bacteriemia tiene su origen en la adherencia de los microorganismos y en la colonización de la superficie del catéter hasta la formación del biofilm, por lo que, si se logra controlar la formación de dicho biofilm tanto a nivel de los ramales del CVC-HD como en el OS, se podría incidir sobre la prevención de bacteriemias relacionadas con el catéter15. Las Guías de Práctica Clínica1-3,16 recomiendan una serie de medidas entre las que se incluyen el lavado de manos, el uso de elementos barrera estériles durante la manipulación o empleo de clorhexidina como antiséptico. La guía GEMAV1 establece como un indicador estándar de calidad excelente, cifras de BRC inferiores a 1 episodio por 1.000 días-catéter. Los datos que se han reportado en nuestra serie alcanzan dicho estándar de calidad (0,395 y 0,085 episodios por 1.000 días-catéter, para infecciones del OS y BRC respectivamente), reforzando que los cuidados aplicados sobre los CVC-HD son los correctos.
Sin embargo, el uso del AGC se presenta como una posible alternativa para el cuidado del OS y, por lo tanto, para la prevención de infecciones relacionadas con el catéter. Estudios previos han demostrado resultados muy satisfactorios para la prevención tanto de bacteriemias como de la colonización del CVC en dispositivos temporales17-18. Azzopardi et al.19 analizaron cuatro revisiones sistemáticas, en las que se comparan el uso del AGC con apósitos de gasa o apósitos transparentes de poliuretano. En todas ellas reportaron resultados estadísticamente significativos a favor del AGC. Sin embargo, para los catéteres de larga duración o catéteres tunelizados, la bibliografía no es tan extensa.
Riguetti et al20, realizaron un ensayo clínico sobre pacientes en hemodiálisis que se dializaban a través de un CVC-HD tunelizado, en el que comparaban el AGC y el apósito de poliuretano convencional. Obtuvieron un descenso de la tasa de infección del OS del 1,03 a 0,19 episodios por 1.000 días-catéter con el uso del AGC y cifras de BRC que descienden de 0,37 a 0,09 episodios por 1.000 días-catéter. Resultados similares también se objetivaron en la serie de Apata et al.21, estudio realizado también sobre pacientes portadores de CVC-HD tunelizados, en el que la tasa de BRC se redujo un 52% al utilizar AGC para la cura del OS. Sin embargo, en este caso, el apósito utilizado previamente era un apósito de gasa estéril, lo que supuso, además, no sólo un cambio en el apósito, sino también, en la frecuencia de las curas, ya que el apósito de gasa requería un cambio diario y el AGC se cambia cada 7 días, por lo que esa menor manipulación del OS puede tener también efecto sobre un menor riesgo de infección22. En nuestro estudio no hubo diferencias estadísticamente significativas con respecto a las tasas de BRC. Esto probablemente sea debido a que nuestra población dispone de bioconectores en ambos grupos, que disminuyen el riesgo contaminación durante la conexión, e intraluminal, y que nuestro grupo ya publicó el impacto de su uso en la disminución de tasas de BRC23. La disminución por otro lado de la contaminación de la piel adyacente al punto de inserción con el uso de AGC junto con el uso de bioconectores, en poblaciones de adultos con alto riesgo de infecciones, puede suponer un alto grado de protección, quedando expuestos sólo a la posible contaminación de la solución de infusión o baño de diálisis.
En nuestra muestra, sí que hubo diferencias estadísticamente significativas a favor del uso de AGC para prevenir infecciones del OS, objetivándose un efecto protector. Siguiendo esta misma tendencia, Puig et al.24, en su revisión sistemática, concluyen que el AGC disminuye la infección del OS en los catéteres de larga duración (RR 0,37; 95% CI: 0,22-0,64) en comparación con el uso de apósitos de gasa estéril.
Es importante vigilar activamente los CVC-HD y establecer buenas vías de diagnóstico precoz, ya que entre el 4-20% de las infecciones del OS pueden acabar provocando una BRC7. En nuestra muestra, sólo en 1 de los 3 casos de BRC se produjeron datos previos de infección de OS, aunque al ser una tasa tan baja, no resulta muy representativo.
Los agentes infecciosos analizados en nuestra serie son mayoritariamente Gram positivos (Estafilococo Coagulasa negativo y Estafilococo Epidermidis), situación similar a lo que reporta la bibliografía9-11, gérmenes residentes en la superficie de la piel, que por vía extraluminal, pueden contaminar el catéter23,25, por lo que es esencial la limpieza y desinfección de la piel circundante del OS del CVC-HD con clorhexidina. Para la mayoría de los agentes patógenos, la exposición prolongada a la clorhexidina, está directamente relacionada con un mayor efecto bactericida19. El uso de AGC permite la aplicación continua de clorhexidina sobre el OS23, situación que ya ha demostrado ser eficaz para la prevención de eventos infecciosos en los CVC de corta duración o de áreas críticas.
La actualización de 2017 de la guía de los CDC indica el uso de AGC en pacientes mayores de 18 con indicación de alto riesgo de BRC, como son los catéteres de corta duración y no tunelizados, con un grado de evidencia IA26. En nuestro caso los catéteres estudiados son tunelizados de larga duración de pacientes en hemodiálisis, en los que no hay ensayos clínicos de calidad como para poder realizar recomendaciones basadas en evidencia. Sin embargo, consideramos que pacientes con situaciones concomitantes de inmunodeficiencias (VIH, diabetes, tratamiento con quimioterapia, etc), BRC recurrentes o necesidad de múltiples sesiones de hemodiálisis que aumenten el riesgo de exposición27, podrían verse beneficiados del uso de AGC.
La principal limitación del estudio es el corto periodo de seguimiento, ya que resultaría interesante comprobar los efectos a largo plazo de la clorhexidina mantenida sobre el OS, las posibles reacciones cutáneas y/o posibles resistencias, así como la posible relación entre las infecciones del OS con bacteriemias posteriores en el mismo paciente.
En conclusión, según los datos obtenidos, la cura con AGC presenta menor tasa de incidencia de infección del orificio de salida que la cura con clorhexidina en solución con apósito convencional, de manera estadísticamente significativa. Además, la cura con AGC, ha resultado ser una medida protectora frente a la infección del orificio de salida en comparación al uso de clorhexidina en solución y apósito de poliuretano convencional. Aunque tanto la frecuencia absoluta de BRC, como la densidad de incidencia de BRC fue menor en el grupo del AGC que en el control, no hubo diferencias estadísticamente significativas con respecto a las BRC. Son necesarias nuevas investigaciones, con muestras más amplias y durante mayor periodo de seguimiento para confirmar datos y posibles efectos adversos, que permitan realizar recomendaciones basadas en evidencia.
Conflicto de intereses
Los autores declaran cómo único conflicto de interés, que los apósitos de gluconato de clorhexidina empleados en el estudio fueron financiados por la casa comercial (3MTM).
Financiación
Los autores declaran no haber recibido financiación alguna.
BIBLIOGRAFÍA
1. Ibeas J, Roca-Tey R, Vallespín J, Quereda C, Crespo R, Ochando A, Cobo JL. Guía Clínica Española del Acceso Vascular para Hemodiálisis. Enferm Nefrol 2018;21:S1-256.
2. Schmidli J, Widmer MK, Basile C, de Donato G, Gallieni M, Gibbons CP et al. Vascular Access: 2018 Clinical Practice Guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg 2018;55:757-818.
3. Lok CE, Huber TS, Lee T, Shenoy S, Yevzlin AS, Abreo K, et al; National Kidney Foundation. KDOQI Clinical Practice Guideline for Vascular Access: 2019 Update. Am J Kidney Dis 2020;75(4 Suppl 2):S1-164.
4. Sosa Barrios RH, Burguera Vion V, Gomis Couto A. Accesos Vasculares Percutáneos: Catéteres. En: Lorenzo V., López Gómez JM (Eds). Nefrología al día. [Internet] [consultado 23 May 2023]. Disponible en: https://www.nefrologiaaldia.org/326.
5. Johansen KL, Chertow GM, Gilbertson DT, Ishani A, Israni A, Ku E et al. US Renal Data System 2022 Annual Data Report: epidemiology of kidney disease in the United States. Am J Kidney Dis. 2023;81(3 Suppl 1):A1-A674.
6. Organización Catalana de Trasplante (OCATT). Registro de pacientes renales de Cataluña, Informe estadístico 2020. Barcelona: Departamento de Salud. Generalitat de Cataluña; Abril 2022.
7. Cobo-Sánchez JL, Blanco-Mavillard I, Pelayo-Alonso R, Mancebo-Salas N, Fernández-Fernández I, De Pedro-Gómez JE. Validity of a catheter exit site clinical assessment scale for the early detection of exit site infections in patients on haemodialysis with a central venous catheter: protocol for a multicentre validation study in Spain (EXITA Study). BMJ Open 2022;12(9):e065724.
8. Fisher M, Golestaneh L, Allon M, Abreo K, Mokrzycki MH. Prevention of Bloodstream Infections in Patients Undergoing Hemodialysis. Clin J Am Soc Nephrol 2020;15(1):132-51.
9. Suzuki M, Satoh N, Nakamura M, Horita S, Seki S, Moriya K. Bacteremia in hemodialysis patients. World J Nephrol 2016;6;5(6):489-96.
10. Hidalgo MA, Moreno MC, Sánchez MA, Prats M, Puigt M. Análisis de las complicaciones del acceso vascular en hemodiálisis. Una revisión sistemática. Enferm Nefrol 2023;26(2):106-18.
11. Sánchez I, Lorenzo V. ¿Se infectan más los catéteres tunelizados para diálisis cuando los pacientes ingresan en el hospital? Enferm Nefrol 2019;22(3):266-73.
12. Bueloni TNV, Marchi D, Caetano C, de Souza Cavalcante R, Mendes Amaral ML, Ponce D. Cefazolin-gentamicin versus taurolidine-citrate for the prevention of infection in tunneled central catheters in hemodialysis patients: A quasi-experimental trial. Int J Infect Dis 2019;85:16-21.
13. Fariñas MC, García JD, Gutiérrez M. Infecciones asociadas a los catéteres utilizados para la hemodiálisis y la diálisis peritoneal. Enferm Infecc Microbiol Clin. 2008;26(8):518-26.
14. Crespo M, Ruiz MC, Gómez M, Crespo R. Las bacteriemias relacionadas con el catéter tunelizado de hemodiálisis y cuidados de enfermería. Enferm Nefrol 2017;20(4):353-65.
15. Pascual Á, Cercenado E, Salavert M, Elías García-Sánchez J, Eiros JM, Liñares J, et al. Update on pathogenesis and diagnosis of intravascular catheter-related infections. Enferm Infecc Microbiol Clin 2011;16–21.
16. CDC Approach to BSI prevention in dialysis facilities. Dialysis safety. Centers of Disease Control and Prevention. [Internet] [consultado 15 Jul 2023]. Disponible en: https://www.cdc.gov/dialysis/prevention-tools/core-interventions.html.
17. Wei L, Li Y, Li X, Bian L, Wen Z, Li M. Chlorhexidine-impregnated dressing for the prophylaxis of central venous catheter-related complications: a systematic review and meta-analysis. BMC Infect Dis 2019;19(1):429.
18. Timsit JF, Baleine J, Bernard L, Calvino-Gunther S, Darmon M, Dellamonica J et al. Expert consensus-based clinical practice guidelines management of intravascular catheters in the intensive care unit. Ann Intensive Care 2020;10(1):118.
19. Azzopardi A, Trapani J. Chlorhexidine-based versus non-chlorhexidine dressings to prevent catheter-related bloodstream infections: An evidence-based review. Nurs Crit Care 2022:1-5.
20. Righetti M, Palmieri N, Bracchi O, Prencipe M, Bruschetta E, Colombo F et al. TegadermTM CHG dressing significantly improves catheter-related infection rate in hemodialysis patients. J Vasc Access 2016;17(5):417–22.
21. Apata IW, Hanfelt J, Bailey JL, Niyyar VD. Chlorhexidine-impregnated transparent dressings decrease catheter-related infections in hemodialysis patients: a quality improvement project. J Vasc Access 2017;18(2):103-8.
22. Jeanes A, Bitmead J. Reducing bloodstream infection with a chlorhexidine gel IV dressing. Br J Nurs 2015 Oct 22-Nov 11;24(19):S14-9.
23. Cobo Sánchez JL, Sainz Alonso RA, Vicente Jiménez MY, Cepa García H, Pelayo Alonso R, Menezo Viadero R et al. Estudio comparativo de incidencia de bacteriemias relacionadas con el catéter de hemodiálisis: bioconectores frente a conexión directa. Rev Soc Esp Enferm Nefrol 2011;14(4):230-5.
24. Puig-Asensio M, Marra AR, Childs CA, Kukla ME, Perencevich EN, Schweizer ML. Effectiveness of chlorhexidine dressings to prevent catheter-related bloodstream infections. Does one size fit all? A systematic literature review and meta-analysis. Infect Control Hosp Epidemiol 2020 Dec;41(12):1388-95. DOI: 10.1017/ice.2020.356.
25. Safdar N, O’Horo JC, Ghufran A, Bearden A, Didier ME, Chateau D, Maki DG. Chlorhexidine-impregnated dressing for prevention of catheter-related bloodstream infection: a meta-analysis. Crit Care Med 2014 Jul;42(7):1703-13.
26. O’Grady NP, Alexander M, Burns LA, Dellinger EP, Garland J, Heard SO et al. Guidelines for the Prevention of Intravascular Catheter-Related Infections (Update 2017). [internet] [consultado 15 Jul 2023]. Disponible en: https://www.cdc.gov/infectioncontrol/pdf/guidelines/bsiguidelines-H.pdf
27. Wang L, Jia L, Jiang A. Pathology of catheter-related complications: what we need to know and what should be discovered. J Int Med Res 2022 Oct;50(10):3000605221127890.
Este artículo se distribuye bajo una Licencia Creative Commons Atribución–NoComercial 4.0 Internacional.
https://creativecommons.org/licenses/by-nc/4.0/
