Impacto del sexo del donante y del receptor en los niveles de hemoglobina de los receptores de riñón al año de seguimiento
Ana Laura Quiroz-Ramírez1, Ramón Espinoza-Pérez2, Manuel Bautista-Hernández1, Jorge Romero-Martínez1, Julissa Madai Velasco-Durán1, Juan Carlos H. Hernández-Rivera3
1Escuela Superior de Medicina. Instituto Politécnico Nacional. Ciudad de México. México
2 Unidad de Trasplante Renal. Centro Médico Nacional “Siglo XXI” Ciudad de México. México
3 Unidad de Investigación Médica en Enfermedades Nefrológicas. Centro Médico Nacional “Siglo XXI” Ciudad de México. México
https://doi.org/10.37551/S2254-28842023032
Como citar este artículo:
Quiroz-Ramírez AL, Espinoza-Pérez R, Bautista-Hernández M, Romero-Martínez J, Velasco-Durán JM,Hernández-Rivera JCH.
Impacto del sexo del donante y del receptor en los niveles de hemoglobina de los receptores de riñón al año de seguimiento.
Enferm Nefrol 2023;26(4):337-43
Correspondencia:
|
Recepción: 06-03-2023
|
RESUMEN
Introdución: El trasplante renal es la mejor terapia de reemplazo renal, el cual depende de múltiples factores para un funcionamiento como condiciones del donador, del receptor y sociodemográficas.
Objetivo: Evaluar el efecto del sexo de los donadores y receptores durante el primer año después del trasplante en los valores de hemoglobina.
Material y Método: Estudio de cohorte retrospectiva de receptores renales del 2014 al 2019, realizado en el Hospital de Especialidades del Centro Médico Nacional Siglo XXI (Ciudad de México). Se incluyeron a todos los trasplantados, excluyendo fallecidos, pérdida del injerto y pérdida de seguimiento en la institución. Se estudiaron sexo y edad del donante y receptor, tipo de donante renal (vivo o fallecido), hemoglobina antes del trasplante renal y la hemoglobina al año del trasplante, y creatinina sérica.
Resultados: Se analizaron 914 pacientes, se excluyeron 109 por diversos motivos, quedando 805 pacientes que completaron los 12 meses de seguimiento. En el caso de donaciones de masculino a femenino, la mediana de hemoglobina del receptor a los 12 meses fue de 15,2 g/dL (Percentil 25-Percentil 75: 13,7-16,0 g/dL), de masculino a masculino de 15,2 g/dL (Percentil 25-Percentil 75: 13,4-16,6 g/dL), de femenino a femenino de 14,0 g/dL (Percentil 25-Percentil 75: 12,4-15,3 g/dL) y femenino de masculino de 13,5 g/dL (Percentil 25-Percentil 75: 12,5-14,8 g/dL).
Conclusiones: Los niveles de hemoglogina no parecen estar influenciados por la masa nefronal, como sí otras funciones del injerto (depuración de creatinina). La regulación de la hemoglobina guarda relación con el sexo del receptor.
Palabras clave: trasplante renal; hemoglobina; sexo; donante de órganos; receptor; anemia; trasplante de órganos.
ABSTRACT
Impact of donor and recipient sex on hemoglobin levels of kidney recipients at one-year follow-up
Introduction: Kidney transplantation is the optimal renal replacement therapy, dependent on various factors such as donor, recipient, and sociodemographic conditions for optimal functioning.
Objective: To assess the effect of donor and recipient sex during the first year post-transplant on hemoglobin values.
Material and Method: A retrospective cohort study of kidney recipients from 2014 to 2019 was conducted at the Hospital de Especialidades of Centro Médico Nacional Siglo XXI (Mexico City). All transplant recipients were included, excluding those who died, experienced graft loss, or were lost to follow-up at the institution. Donor and recipient sex and age, type of renal donor (living or deceased), hemoglobin before renal transplant, hemoglobin at one-year post-transplant, and serum creatinine were studied.
Results: A total of 914 patients were analyzed, with 109 excluded for various reasons, resulting in 805 patients who completed the 12-month follow-up. In cases of male-to-female donations, the median recipient hemoglobin at 12 months was 15.2 g/dL with an interquartile range (IQR 25-75) of 13.7-16.0 g/dL; male-to-male donations had a median of 15.2 g/dL (IQR 25-75 13.4-16.6 g/dL); female-to-female donations had a median of 14.0 g/dL (IQR 25-75 12.4-15.3 g/dL), and female-to-male donations had a median of 13.5 g/dL (IQR 25-75 12.5-14.8 g/dL).
Conclusions: Hemoglobin levels do not appear to be influenced by nephron mass, as with other graft functions (creatinine clearance). Hemoglobin regulation is associated with the recipient’s sex.
Keywords: kidney transplant; hemoglobin; sex; organ donor; recipient; anemia, organ transplantation.
INTRODUCCIÓN
La anemia en el paciente postrasplantado se define de acuerdo a la Organización Mundial de la Salud (OMS) y a la Sociedad Americana de Trasplantes (AST por sus siglas en inglés American Society of Transplantation) de acuerdo a los siguientes puntos de corte en los valores de hemoglobina (Hb): <13,0 g/dL en hombres, <12,0 g/dL en mujeres y <11,0 g/dL para definir anemia grave en ambos sexos1,2.
Una revisión descriptiva sobre el síndrome anémico realizada en 2021, muestra que ésta es dos veces más frecuente en personas con Enfermedad Renal Crónica (ERC) en un 15,4%, que en la población general con un 7,6%; su prevalencia aumenta conforme avanza el estadio de ERC en que se encuentre3. Los datos más recientes de la Encuesta Nacional del Examen de Salud y Nutrición (NHANES por sus siglas en inglés: National Health and Nutrition Examination Survey) mostraron que los niveles de Hb comienzan a descender a medida que desciende la Tasa de filtración glomerular (TFG). Como cabe esperar, la anemia es una complicación frecuente en los pacientes sometidos a Trasplante Renal (TR), con una frecuencia reportada de 20-51% durante el tiempo de la funcionalidad del injerto de acuerdo a un análisis realizado en 20193-5.
Desde el momento en el que el riñón donado comienza a funcionar en el paciente receptor, se ha visto un incremento en el valor de la Hb, y esto se debe a que la eritropoyetina (EPO) comienza a ser producida por los fibroblastos intersticiales en la corteza renal, muy cerca de las células epiteliales tubulares y los capilares peritubulares para posteriormente unirse a los receptores de EPO homodímeros de los eritrocitos (encontrados en las células eritroides tempranas, proeritroblasto)3,6, se ha visto un incremento de los valores de la Hb a los 5 días, 6 meses y al año del trasplante, esto se explica por un buen flujo sanguíneo que pasa a través del injerto6. Sin embargo, los valores de Hb son dependientes inversamente con los valores de creatinina y por ende con la funcionalidad del injerto. De acuerdo a los mecanismos fisiopatológicos de los factores inducibles de hipoxia (HIF por sus siglas en inglés)7,8, se espera un mantenimiento de los niveles de EPO por el riñón nativo, lo cual permitiría mantener un nivel apropiado de EPO por un tiempo limitado en caso de que exista un rechazo renal. Aunque esto no siempre es posible debido a la función renal residual casi nula8.
Acorde a su clasificación podemos encontrar: anemia temprana, cuya principal causa es por deficiencia de hierro, secundario a una pobre ingesta, al agotamiento de las reservas antes del trasplante y por la pérdida de sangre durante el perioperatorio, una lenta producción de EPO por parte del injerto8,9. Por otro lado, en la anemia tardía, la cual se establece cuando la anemia persiste después del primer mes del trasplante, donde la causa principal es un fallo en la función del injerto8,9. Existen algunas causas que no dependen de la temporalidad como: supresión generalizada de la médula ósea por inmunosupresores, fármacos como cloranfenicol, ganciclovir o inhibidores de la enzima convertidora de angiotensina, infecciones virales como: citomegalovirus, Epstein-Barr, parvovirus B19, aplasia pura de células rojas, síndrome hemolítico urémico, anemia hemolítica, incompatibilidad ABO, enfermedad de células falciformes, deficiencia de glucosa-6 fosfato deshidrogenasa, lesión renal aguda por necrosis tubular o rechazo agudo8-10. En este artículo se mencionarán algunos aspectos importantes acerca de la diferencia existente entre los valores de Hb por sexo en los pacientes postrasplantados en relación con el sexo del donador, esto debido a que existen algunas condiciones relacionadas con el sexo, por ejemplo mayor masa nefronal en donadores hombres, en comparación con mujeres; en cambio la producción de hemoglobina no parece tener una influencia en la masa nefronal asociada al sexo del donante, como si lo es los niveles de creatinina, por lo que surge como objetivo evaluar el efecto del sexo de los donadores y receptores a un año después del trasplante en los valores de Hb.
MATERIAL Y MÉTODO
Diseño y ámbito del estudio
Se estudió una cohorte retrospectiva de pacientes trasplantados renales en la Unidad de Trasplante en el Hospital de Especialidades del Centro Médico Nacional Siglo XXI del Instituto Mexicano del Seguro Social (IMSS) en la Ciudad de México.
Población y muestra
Se consideraron elegibles para la muestra los pacientes que fueron trasplantados en el periodo del 01 de enero de 2014 a 31 de diciembre del 2019. Los elegibles fueron aquellos pacientes trasplantados en el periodo establecido, ambos sexos, mayores de 18 años y que tuviesen al menos un periodo de seguimiento de un año. Se excluyeron del estudio a los pacientes que fallecieron antes del año de seguimiento, sufrieron pérdida del injerto renal igualmente antes de cumplir el año de trasplante, se cambiaron a otra terapia de reemplazo renal o aquellos en los que hubo una pérdida de seguimiento dentro de la institución.
Variables del estudio y obtención de datos
Se obtuvieron los datos de sexo del donante, sexo del receptor, tipo de donante renal (vivo o fallecido), Hb antes del trasplante renal y la hemoglobina al año, edad del donador, edad del receptor, bioquímicas de creatinina al año de los expedientes clínicos de cada uno de los pacientes de los registros del hospital a través personal específicamente capacitado.
Análisis Estadístico
Los datos se presentan como promedios ± desviación estándar para las variables continuas, o como medianas y rangos intercuartílicos 25-75 para las variables nominales o de libre distribución. Para evaluar las diferencias entre los grupos por la combinación de sexo entre donadores y receptores (4 grupos: receptor masculino de donador masculino, receptor masculino de donador femenino, receptor femenino de donador femenino y receptor femenino de donador masculino) se estableció con chi cuadrado para las variables cualitativas y con t student o Kruskal-Wallis con U Mann Whitney para la diferencia intra variable. Para establecer riesgo de Hb baja al año de seguimiento se realizó modelo de regresión logística primero bivariado, después multivariado con ajuste de intervalo de confianza al 95% y coeficiente de determinación, se consideró estadísticamente significativo un valor de p<0,05. Para el análisis se empleó el paquete estadístico SPSS v26.
Aspectos éticos
Se contó con la aprobación del protocolo de estudio por parte de los Comités de Investigación y Ética institucionales, así como la adhesión a la Declaration of Istambul on Organ Trafficking and Transplant Tourism.
RESULTADOS
Se analizó la base inicial de 914 pacientes, de los cuales se excluyen 109 por diversos motivos: defunción antes del año de seguimiento, pérdida del injerto renal y con ello cambio a otra terapia de reemplazo renal o pérdida de seguimiento dentro de la institución, quedando para el análisis 805 pacientes con injerto funcional y que a los 12 meses se contaban en sus análisis clínicos con el valor de hemoglobina.
El sexo masculino fue el más prevalente tanto en el grupo de receptores renales con 473 personas (58,80%), como en donadores con 408 (50,70%). La separación por grupos de acuerdo a la combinación por sexo fue la siguiente: grupo 1 de receptor masculino que obtuvieron el injerto de donador femenino fueron 244 binomios (30,31%), grupo 2 de receptor masculino de donador masculino fueron 229 binomios (28,45%), grupo 3 de receptor femenino de donador femenino fueron 153 binomios (19,00%) y grupo 4 de receptor femenino de donador masculino fueron 179 binomios (22,24%).
Cuando se hizo la separación entre los receptores renales de donante vivo (familiar, amigo, etc.) y aquellos receptores renales de donante fallecido con las medias de los valores de hemoglobina tanto antes del trasplante, como la Hb al año de la cirugía de trasplante, se observaron diferencias de las medias de Hb estos 2 grupos: p=0,001 en el caso de la Hb antes del trasplante renal y p=0,037 de la hemoglobina a los 12 meses del trasplante. Ver diferencia entre los grupos en la tabla 1, analizado por comparación de proporciones por columna.
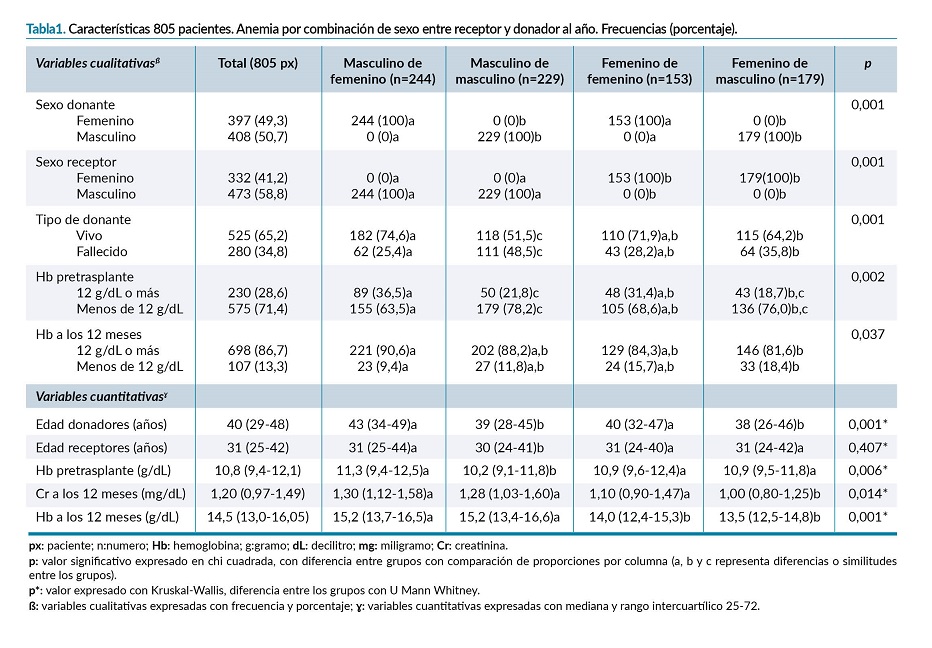
En el caso de las variables cuantitativas, también existió diferencia entre los 4 grupos en la edad de los donantes (p=0,001), la Hb pretrasplante (p=0,006), la creatinina a los 12 meses (p=0,014) y Hb a los 12 meses (p=0,001), en el caso de todas estas variables se representa por U de Mann Whitney donde se encuentran las diferencias en la tabla 1. No existió una diferencia estadísticamente significativa entre los grupos en el caso de la edad de los receptores (p=0,407).
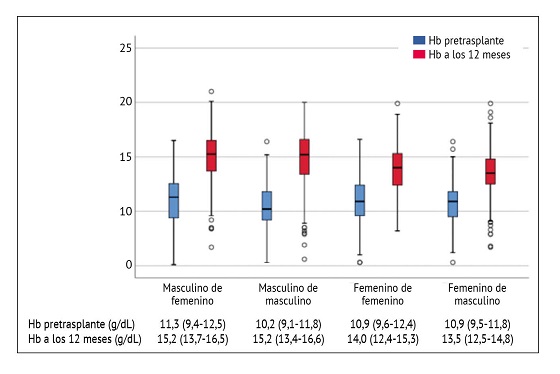
El comportamiento de la Hb partiendo de la mediana previo al trasplante renal comparado con la Hb a los 12 meses después del evento quirúrgico se observa en la figura 1, en el caso del grupo 1 (masculino de femenino) la elevación fue de 3,9 g/dL, situándose en 15,2 g/dL con un rango intercuartílico 25-75 (RIC 25-75) 13,7-16,0 g/dL, el grupo 2 (masculino de masculino) también se situó al año con una mediana por arriba de 15 gramos con 15,2 g/dL (RIC 25-75 de 13,4-16,6 g/dL) con elevación de 5 g. En el caso del grupo 3 (femenino de femenino) el aumento pretrasplante a los 12 meses fue de 3,1 g/dL, con una mediana de 14,0 g/dL (RIC 25-75 de 12,4-15,3 g/dL); el grupo que menos representó una elevación fue el grupo 4 (femenino de masculino) con 2,6 g/dL, quedando su mediana al año en 13,5 g/dL (RIC 25-75 de 12,5-14,8 g/dL). Ver figura 1.
En el análisis de regresión logística para evaluar el riesgo de Hb menor de 12,00 g/dL al año de seguimiento se incluyeron los 4 grupos por el sexo combinado de los binomios, la obtención del riñón por donante fallecido, creatinina sérica a los 12 meses, y la edad del receptor. Dentro de estas variables las que mostraron riesgo estadísticamente significativo fue el recibir un riñón de donante fallecido para cursar con anemia al año de seguimiento con un odds ratio (OR) de 2,28 con un intervalo de confianza al 95% (IC 95%) de 1,39 a 3,73, con p=0,001. Del mismo modo por cada gramo de elevación de creatinina el riesgo de tener anemia tuvo un OR de 2,61 (IC 95% 1,96-3,48, p=0,001), también receptor femenino que recibió de un donador femenino con un OR de 2,14 (IC 95% 1,08-4,26, p=0,029) y por último el receptor femenino de donador masculino con un OR de 3,26 (IC 95% 1,69-6,29, p=0,000). Las variables del modelo sin significancia fueron la edad del receptor (p=0,160) y el receptor masculino de donador masculino (p=0,857). Ver tabla 2.

DISCUSIÓN
En nuestro estudio, de un total de 805 pacientes, el 71,40% (n=575) presentó una Hb menor a 12,00 g/dL y el 28,60% (n=230) una Hb mayor a 12,00 g/dl antes de ser trasplantados. A los 12 meses del trasplante, el 86,70% (n=698) de la población obtuvo una Hb mayor a 12,00 g/dl y el 13,30% (n=107) menor a 12,00 g/dl. De acuerdo con nuestros resultados, la prevalencia de pacientes con Hb menor a 12,00 g/dL, disminuye durante el primer año postrasplante. Otros estudios confirman la disminución de la prevalencia, sin embargo, los porcentajes difieren de forma significativa. En el estudio de Jeong y col11, se encontró una media de Hb al año de 13,64 g/dL contra 10,53 g/dL de Hb al momento del TR con una disminución de la prevalencia de anemia, según los criterios de la OMS, de 88,04% a 72,77%. En el estudio de Jones y col12, la prevalencia disminuyó de 88,60% al mes a 49,30% al año y 44,30% a los 24 meses con una media de Hb de 10,70 g/dL, 12,40 g/dL y 12,50 g/dL respectivamente. En un estudio retrospectivo en el Centro Médico Nacional en la Ciudad de México en 201313, la media de Hb pretrasplante fue de 10,69 g/dl y un año después de 14,45 g/dL, disminuyendo la prevalencia de anemia de 76,60% a 12,90% al año tomando como valor de referencia la Hb menor a 12,00 g/dl. La variabilidad de los resultados en los estudios anteriores puede atribuirse al enfoque en la prevalencia de anemia y por lo tanto a la diferencia en el punto de corte de acuerdo al sexo para definirla. En contraste, nuestro estudio cuenta con un enfoque en la elevación de Hb al año por sexo tanto del donador como del receptor.
De acuerdo con los resultados obtenidos, los factores de riesgo para presentar una Hb menor a 12,00 g/dL al año de seguimiento fueron: 1) recibir un riñón de donante fallecido, 2) elevación de la creatinina, 3) receptor femenino que recibió de un donador femenino y 4) receptor femenino de donador masculino. Lim y col14, identificaron que los factores de riesgo a los 6 meses después del TR fueron: sexo femenino, retraso de la función del injerto, saturación de transferrina menor al 10%, tratamiento con inmunoglobulina intravenosa y proteinuria, además por cada incremento en 5,0 ml/min/m2 en la TFG fue asociada con disminución del 19% de probabilidades de tener anemia a los 6 meses. A los 12 meses, los factores de riesgo fueron el sexo femenino, función del injerto, infección reciente, saturación de transferrina 10% y proteinuria. R Marcen y col15, encontraron 3 variables significativas relacionadas con anemia: inmunosupresión con ciclosporina, creatinina sérica al egreso y albúmina sérica a los 12 meses. Estos hallazgos sugirieron que la calidad del órgano trasplantado y los componentes de desnutrición/inflamación podrían ser factores de riesgo que determinan la incidencia de anemia a 1 año, Jeong y col11, determinaron que los factores de riesgo para anemia al año del trasplante fueron: donador fallecido, receptor femenino, donador femenino, Hb del donador, ferritina al momento del trasplante y al año, saturación de transferrina al año, TFG al año, albúmina al momento del trasplante y al año y proteína C reactiva (PCR) al año, Jones y col12, describieron factores independientes asociados con elevación de Hb que incluyen: sexo masculino, TFG, nivel sérico de bicarbonato, uso de Inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA II) y aquellos predictores independientes de disminución de Hb fueron raza afroamericana, niveles de hierro, uso de agentes estimuladores de la eritropoyesis y dosis de prednisona mayores a 10 mg/día. La mayoría de los estudios7,14,15 coinciden en que el sexo femenino del receptor representa un factor de riesgo para anemia, el sexo del donador no se toma en cuenta en la mayoría de los estudios anteriores, sin embargo, Jeong y col11, en contraste con nuestros resultados, identifican al donador femenino como un factor de riesgo. Además, otros factores como la disminución en la TFG y los niveles altos de Cr se han relacionado con anemia en el paciente postrasplantado de acuerdo a los estudios presentados anteriormente11,12.
Dentro de los mecanismos que diferencian los niveles de Hb entre hombres y mujeres encontramos: los regulados por testosterona, el rol de la hepcidina, el efecto de los estrógenos, y los niveles de 2,3 difosfoglicerato. Se ha propuesto que la testosterona estimula indirectamente la eritropoyesis al aumentar la masa muscular en hombres16, en el caso de nuestro estudio este efecto cobra sentido al observarse mayores valores de hemoglobina en los receptores hombres, donde los valores de testosterona son más altos y se regularizan posterior al trasplante renal; del mismo modo aumenta la producción de eritrocitos al estimular mediante receptores androgénicos a los eritroblastos aumentando su sensibilidad a la eritropoyetina y la captación de hierro por las células eritroides17, de ahí que la diferencia de los receptores hombres al año con las mujeres oscile entre 1,20 a 1,70 g/dL en nuestro estudio; así favorece hasta 65% de Hb mayor en comparación con las mujeres; se sugiere que los estrógenos inhiben la eritropoyesis al suprimir la producción de un precursor extrarrenal del factor estimulante de la eritropoyesis (ESF) que requiere activación por un mecanismo renal para la elaboración del ESF circulante funcional18. La hepcidina es un péptido producido por los hepatocitos en procesos infecciosos e inflamatorios, regula la absorción de hierro a nivel intestinal y su distribución corporal mediante la supresión de ferroportina en la membrana celular (único exportador de hierro celular); impide el uso de hierro absorbido o almacenado para la eritropoyesis por parte de la médula ósea1, esta situación en el contexto de nuestro estudio es difícil de evaluar, sin embargo es conocido que los depósitos de hierro son diferentes por sexo, siendo menores en las mujeres, por lo que los niveles de hemoglobina pueden explicarse superiores en los hombres; para nuestro estudio los niveles promedio de hemoglobina en hombres fue de 15,20 g/dL y en las mujeres de 13,85 g/dL. Se ha demostrado que la testosterona aumenta la expresión de ferroportina esplénica, reduce la retención de hierro en macrófagos esplénicos y que el receptor de andrógenos unido a ligando se asocia a Smad1 y Smad4 para interrumpir la señalización de BMP/Smad (Proteínas morfogenéticas óseas/proteínas Smad) e inhibir la transcripción de hepcidina19. La presencia de 2,3 difosfoglicerato provoca una disminución de la afinidad de la Hb por el O2, este se encuentra en niveles más altos en mujeres, lo que explica menores concentraciones de Hb20. Nuevamente un mecanismo que en el caso de nuestro estudio es difícil de comprobar, algo que puede prestarse a estudio futuro.
Los esfuerzos futuros para optimizar los niveles de hemoglobina deben centrarse en una mejor comprensión de los factores del receptor que subyacen a los resultados del trasplante, las características del receptor (sexo) y, en consecuencia, el impacto a largo plazo en el paciente postrasplantado. En relación a lo anterior, proponemos un estudio de casos y controles, donde se incluyan como variables edad y sexo del receptor y donador, altitud, tabaquismo, niveles de hemoglobina previos al trasplante, bilirrubina directa e indirecta, así como hipertensión arterial y diabetes mellitus. El resultado de dichas variables permitiría reforzar la explicación o no del seguimiento a un año en los valores de hemoglobina.
Dentro de las limitaciones del estudio no se realizó revisión de enfermedades crónicas no transmisibles ni infectocontagiosas previas en donadores y receptores, así mismo no se incluyó como variables toxicomanías como tabaquismo pasivo y/o activo. Se ignoró también la altitud y tipo de terapia previa al trasplante. Basado en estas limitantes, sugerimos un estudio prospectivo con control de todas las variables que potencialmente pueden influir.
Dentro de las conclusiones del trabajo está que la Hb y su producción no tiene una relación directa con la masa nefronal, como si lo tiene la reducción de los azoados, la depuración de creatinina, funciones endocrinológicas, entre otras; por lo que los niveles de Hb al año de realizado el trasplante renal parece tener más una relación con el sexo del receptor y la influencia hormonal.
Conflicto de intereses
Todos los autores declaran no tener ningún conflicto de intereses; del mismo modo se declara seguir todos los lineamientos éticos para la confidencialidad de los datos.
Financiación
No se recurrió a ningún financiamiento institucional o privado para la realización de este estudio.
BIBLIOGRAFÍA
1. Atkinson MA, Warady BA. Anemia in chronic kidney disease. Pediatr Nephrol [Internet]. 2018 [consultado 10 Jun 2022];33(2):227-38. Disponible en: http://dx.doi.org/10.1007/s00467-017-3663-y.
2. Gafter-Gvili A, Gafter U. Posttransplantation anemia in kidney transplant recipients. Acta Haematol [Internet]. 2019 [consultado 29 Jun 2022];142(1):37-43. Disponible en: http://dx.doi.org/10,1159/000496140.
3. Pertuz-Pinzón A, Ismael-Garcia C, Muñoz-Gómez C, Rico-Fontalvo J, Daza-Arnedo R, Pájaro-Galvis N, et al. Anemia en Enfermedad Renal Crónica. Revistas iMedPub [Internet]. 2021 [consultado 29 Jun 2022];17:10. Disponible en https://www.archivosdemedicina.com/medicina-de-familia/anemia-en-enfermedad-renal-cronica.pdf.
4. Mukharram M, Gyulli M, Rinat M, Venera F, Timur R, Dilya F, et al. Prevalence and associated factors of anemia in a Russian population: the Ural eye and medical study. BMC Public Health [Internet]. 2019 [consultado 29 Jun 2022];15. Disponible en: https://bmcpublichealth.biomedcentral.com/articles/10.1186/s12889-019-7016-6.
5. Zavaleta–Martínez Mariana, Chew-Wong Alfredo, Rosas-Cabral Alejandro. Anemia postrasplante renal, su efecto en la función y en la sobrevida del injerto. Lux Medica [Internet]. 2018 [consultado 29 Jun 2022];19-28. Disponible en: https://revistas.uaa.mx/index.php/luxmedica/article/view/1330.
6. Jelkmann W. Regulation of erythropoietin production: Erythropoietin production. The Journal of Physiology [Internet]. 2011 [consultado 29 Jun 2022] 589 (Pt 6); 1251-8. Disponible en: https://doi.org/10.1113/jphysiol.2010.195057.
7. Quezada Adame I, Espinoza Pérez R, Cruz Santiago J, Sevilla González M de la L, Rivas Ruiz R, Delgadillo GÁC, et al. Risk factors for anemia after one year of kidney transplantation. Tren Transpl [Internet]. 2021 [consultado 29 Jun 2022];14(2). Disponible en: https://www.oatext.com/risk-factors-for-anemia-after-one-year-of-kidney-transplantation.php.
8. Gafter-Gvili A, Gafter U. Posttransplantation Anemia in Kidney Transplant Recipients. Acta Hematológica [Internet]. 2019 [consultado 30 Jun 2022];142(1),37-43. Disponible en: https://www.karger.com/Article/Pdf/496140.
9. Schechter A, Gafter-Gvili A, Shepshelovich D, Rahamimov R, Gafter U, Mor E, et al. Post Renal Transplant Anemia: Severity, causes and their association with graft and patient survival. BMC Nephrology [Internet]. 2019 [consultado 30 Jun 2022];20(1):51. Disponible en: https://bmcnephrol,biomedcentral.com/track/pdf/10.1186/s12882-019-1244-y.pdf.
10. Yabu M, Winkelmayer C. Posttransplantation Anemia: Mechanisms and Management, Clinical Journal of the American Society of Nephrology: CJASN [Internet]. 2011 [consultado 30 Jun 2022];6(7):1794-801, Disponible en: https://cjasn.asnjournals.org/content/clinjasn/6/7/1794.full.pdf?with-ds=yes.
11. Jeong JC, Ro H, Yang J, Huh KH, Park JB, Cho J-H, et al. Characteristics of anemia and iron deficiency after kidney transplant. Transplant Proc [Internet]. 2019 [consultado 30 Jun 2022];51(5):1406-9. Disponible en: http://dx.doi.org/10.1016/j.transproceed.2019.01.140.
12. Jones H, Talwar M, Nogueira JM, Ugarte R, Cangro C, Rasheed H, et al. Anemia after kidney transplantation; its prevalence, risk factors, and independent association with graft and patient survival: a time-varying analysis: A time-varying analysis, Transplantation [Internet]. 2012 [consultado 1 Jul 2022];93(9):923-8. Disponible en: http://dx.doi.org/10.1097/TP.0b013e31824b36fa.
13. Rosales Morales KB, Pérez RE, Cancino López JD, Díaz ER, Chacón Pérez MJ, Zavalza Camberos PA, et al. Anemia and erythrocytes: Behavior and prevalence 1 year after kidney transplant. Transplant Proc [Internet]. 2020 [consultado 1 Jul 2022];52(4):1169-72. Disponible en: http://dx.doi.org/10.1016/j,transproceed.2020.01.053.
14. Lim AKH, Kansal A, Kanellis J. Factors associated with anemia in kidney transplant recipients in the first year after transplantation: a cross-sectional study. BMC Nephrol [Internet]. 2018 [consultado 1 Jul 2022];19(1):252. Disponible en: http://dx.doi.org/10.1186/s12882-018-1054-7.
15. Marcén R, Galeano C, Fernandez-Rodriguez A, Jiménez S, Teruel JL, Burgos FJ, et al. Anemia at 1 year after kidney transplantation has a negative long-term impact on graft and patient outcomes. Transplant Proc [Internet]. 2012 [consultado 1 Jul 2022];44(9):2593–5, Disponible en: http://dx.doi.org/10.1016/j.transproceed.2012.09.033.
16. Mancera-Soto E, Ramos-Caballero DM, Magalhaes J, Chaves Gomez S, Schmidt WFJ, Cristancho-Mejía E. Quantification of testosterone-dependent erythropoiesis during male puberty. Exp Physiol [Internet]. 2021 [consultado 2 Jul 2022];106(7):1470-81. Disponible en: http://dx.doi.org/10.1113/EP089433.
17. Shahani S, Braga-Basaria M, Maggio M, Basaria S. Androgens and erythropoiesis: past and present, J Endocrinol Invest [Internet]. 2009 [consultado 2 Jul 2022];32(8):704-16, Disponible en: http://dx.doi.org/10.1007/BF03345745.
18. Mirand E, Gordon A. Mechanism of estrogen action in erythropoiesis. Endocrinology [Internet]. 1966 [consultado 2 Jul 2022].78(2):325-32. Disponible en: https://doi.org/10.1210/endo-78-2-325.
19. Guo W, Schmidt P, Fleming D, Bhasin S. Hepcidin is not essential for mediating testosterone’s effects on erythropoiesis, Andrology [Internet]. 2020 [consultado 2 Jul 2022]; 8(1):82-90. Disponible en: https://doi.org/10.1111/andr.12622.
20. Duncan A, Levin A. Sex, Haemoglobin and kidney disease: New perspectives. European Journal of Clinical Investigation [Internet]. 2005 [consultado 2 Jul 2022];52-7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16281959/.
Este artículo se distribuye bajo una Licencia Creative Commons Atribución–NoComercial 4.0 Internacional.
https://creativecommons.org/licenses/by-nc/4.0/
