Complicaciones nefrourológicas en pacientes sometidos a resección pulmonar según la utilización o no de sondaje vesical
Sonia Martín-Baeza, Livia Franco-de la Fuente, Isabel Vila-Cubell, Esther Díaz-Sánchez, Alicia Irene Gasulla-Guillermo, Ricard Navarro-Ripoll
Hospital Clínic de Barcelona. España.
https://doi.org/10.37551/S2254-28842022010
Como citar este artículo:
Martín-Baeza S, Franco-de la Fuente L, Vila-Cubell I, Díaz-Sánchez E, Gasulla-Guillermo AI, Navarro-Ripoll R. Complicaciones
nefrourológicas en pacientes sometidos a resección pulmonar según la utilización o no de sondaje vesical. Enferm Nefrol.
2022;25(1):83-8
Correspondencia:
|
Recepción: 23-07-2021
|
RESUMEN
Introducción: La implementación del protocolo ERAS (Enhanced Recovery After Surgery) en cirugía torácica ha implicado un cambio en el manejo perioperatorio de los pacientes. Una de las nuevas recomendaciones es evitar la colocación sistémica de sondaje vesical en cirugía pulmonar.
Existe poca evidencia en la bibliografía sobre las complicaciones nefrourológicas postoperatorias. Por ello, diseñamos un estudio con el fin de evaluar la incidencia de complicaciones nefrourológicas en la población sometida a resección pulmonar por videotoracoscopia en función del uso o no del sondaje vesical.
Material y Método: Realizamos un estudio longitudinal prospectivo en la Unidad de Reanimación Postanestésica en un hospital de tercer nivel durante el periodo comprendido entre abril 2019 y julio del 2020 a los pacientes sometidos a resección pulmonar por videotoracoscopia. Se recogieron variables perioperatorias así como la presencia de complicaciones nefrourológicas.
Resultados De los 62 pacientes que ingresaron en URPA sin sondaje vesical, 5 presentaron complicaciones nefrourológicas en las primeras 24 horas postquirúrgicas. 3 de los 5 presentaban volúmenes vesicales estimados por ecografía altos (>300 ml) a la llegada a la URPA y 4 pacientes los presentaban a las 4 horas después de la cirugía. Estas complicaciones no implicaron un deterioro significativo de la función renal durante el ingreso hospitalario.
Conclusiones: La recomendación de evitar el sondaje urinario en cirugía de resección pulmonar parece una práctica segura. Sería muy interesante disponer de herramientas que permitan una detección y monitorización de los pacientes con riesgo incrementado para favorecer la detección precoz de complicaciones.
Palabras clave: catéteres urinarios; cirugía torácica; complicaciones postquirúrgicas; cuidados posoperatorios.
ABSTRACT
Urological and renal complications in patients undergoing pulmonary resection depending on whether or not urinary catheterization is used
Introduction: The implementation of the ERAS (Enhanced Recovery After Surgery) protocol in thoracic surgery has changed the perioperative management of patients. One of the new recommendations is to avoid systematic urinary catheterization during lung surgery.
There is little scientific evidence on postoperative urological and renal complications. Therefore, a study was conducted to evaluate the incidence of urological and renal complications in the population undergoing video-assisted thoracoscopy lung resection by according to the use or not of urinary catheterization.
Method: A prospective longitudinal study in the Postanaesthesia Care Unit (PACU) at a tertiary hospital during the period April 2019 to July 2020 was conducted. Patients undergoing video-assisted thoracoscopy lung resection were included.
Results: Amongst the 62 patients that were admitted in the PACU without urinary catheter, 5 developed urological or renal complications in the first 24 hours after surgery. 3 out of 5 had high sonographic estimated bladder volume (>300 ml) on their PACU admission and 4 out of 5 had high volume 4 hours after surgery. These complications didn’t have a clinically relevant impact on the renal function during hospital stay.
Conclusions: The recommendation to avoid urinary catheterisation in lung resection surgery seems to be a safe practice. It would be relevant to have tools that allow detection and monitoring of patients at increased risk to favour early detection of complications.
Keywords: urinary catheters; thoracic surgery; postoperative complications; postoperative care.
INTRODUCCIÓN
Desde la aparición de los protocolos ERAS (Enhanced Recovery After Surgery) su implementación ha sufrido una rápida expansión a lo largo de diferentes tipos de cirugía1. Los protocolos ERAS establecen recomendaciones basadas en la evidencia. Estas recomendaciones abarcan todo el proceso perioperatorio: el preoperatorio, intraoperatorio y postoperatorio; con el objetivo de mejorar y acelerar la recuperación tras la cirugía2.
La aplicación de las medidas recogidas en los ERAS está bien establecida en cirugía colorrectal, ya que fueron las primeras guías ERAS publicadas en 20053. Debido a sus excelentes resultados, progresivamente se ha extendido a otros tipos de cirugías, incluyendo la cirugía torácica donde las recomendaciones están respaldadas por la Sociedad de Cirugía Torácica Española y la Comisión Europea4. Algunos ejemplos de las recomendaciones ERAS incorporadas a cirugía torácica son la prehabilitación, la optimización de la fluidoterapia y el abordaje mínimamente invasivo, junto con la retirada temprana del drenaje torácico y la no utilización de sondajes vesicales2.
En la cirugía pulmonar existe una alta recomendación de restringir el aporte hídrico, realizar balances neutros y/o negativos5,6. Debido a que se trata de cirugías mayores de duración prolongada, es habitual la colocación de una sonda vesical en las cirugías de resección pulmonar con la finalidad de medir y ajustar con exactitud el balance hídrico.
A pesar de la recomendación de evitar la colocación de sondajes vesicales recogida en las últimas guías1, hay muy poca bibliografía sobre la relación entre la no colocación de sondaje vesical en los pacientes sometidos a cirugía pulmonar y las posibles complicaciones nefrourológicas que se puedan derivar de esta praxis7-9.
Por todo ello, se propuso un estudio que pretendió evaluar la incidencia de las complicaciones nefrourológicas en la población sometida a resección pulmonar por videotoracoscopia (VATS) en función del uso o no del sondaje vesical.
MATERIAL Y MÉTODO
Se diseñó un estudio observacional longitudinal prospectivo durante el periodo comprendido entre abril del 2019 y julio del 2020, en la unidad de reanimación postanestésica (URPA) de un hospital universitario de tercer nivel a la población sometida a resección pulmonar.
Los criterios de inclusión fueron: pacientes mayores de 18 años, programados de manera electiva para resección pulmonar por VATS, con el consentimiento informado previamente firmado. Los criterios de exclusión fueron: la negativa a participar por parte del paciente y la reconversión intraoperatoria a cirugía abierta. Se recogió el consentimiento informado escrito a todos los pacientes antes de la cirugía. Todos los pacientes fueron intervenidos bajo anestesia general, siguiendo las principales recomendaciones recogidas en las últimas guías10. La necesidad de sondaje vesical intraoperatorio se valoró por el anestesiólogo responsable del paciente, que era ajeno al estudio y no tenía información sobre si el paciente había sido incluido o no en él.
El día de la intervención se recogían las variables relacionadas sobre aspectos demográficos, antecedentes de patología nefrourológica previa (definida como patología renal, de vías urinarias, vesical y/o prostática) niveles de creatinina (basales y a las 24 h tras cirugía), tiempo total de anestesia, tipo de analgesia y fluidos administrados durante la cirugía, volumen estimado de orina a través de ecografía vesical URPA (al ingreso y a las 4h tras la cirugía) y la necesidad de sondaje en el intraoperatorio. A la semana de la intervención quirúrgica se revisaba el curso clínico, registrando si hubo necesidad de sondaje vesical durante las primeras 24h del postoperatorio, así como si habían presentado complicaciones nefrourológicas o infección de origen urinario durante el ingreso hospitalario. Se definió que las posibles complicaciones nefrourológicas eran la retención urinaria, considerándose como la imposibilidad de realizar la primera micción tras la intervención quirúrgica, la presencia de globo vesical y lesión renal aguda (LRA) basándonos en la clasificación de la escala RIFLE (Risk, Injury, Failure, Loss y End Stage Kidney Disease)11,12. Para valorar la diferencia entre la sintomatología vesical entre los pacientes sondados y no sondados, se recogió el Cuestionario de Autoevaluación del Control de la Vejiga (CACV)13 al ingreso, y al mes tras la intervención quirúrgica se realizaba una llamada telefónica recogiendo el mismo cuestionario. Se compararon los CACV de los pacientes que habían sido sondados intraoperatoriamente con los CACV de los no sondados.
Análisis estadístico:
Se realizó un análisis estadístico univariante para las variables del estudio cuantitativas, con determinación de medidas de centralización (media y mediana) y dispersión (desviación estándar y rango intercuartílico), según siguieran una distribución normal o no. Las variables cualitativas se presentaron como valores relativos. El nivel de confianza se estableció en el 95%. El análisis estadístico se realizó con Microsoft Excel versión 16,47.
Este estudio cumplió con las normas de Buena Práctica Clínica y se realizó en base a la declaración de Helsinki (World Medical Association Declaration of Helsinki, Fortaleza, Brasil, octubre 2013), también fue autorizado por el Comité Ético del centro hospitalario, nº HCB/2019/0238.
RESULTADOS
Entre abril del 2019 y Julio del 2020 se reclutaron 83 pacientes (figura 1), de los cuales 7 fueron excluidos por la reconversión intraoperatoria a cirugía abierta (toracotomía), por lo que se analizaron los datos de los 76 pacientes restantes, 14 de los cuales recibieron sondaje vesical intraoperatorio, lo que supone el 18% de la muestra.

La edad media de los pacientes a los que no se les había colocado sondaje vesical era de 66±10 años versus 71±8 años de los que sí que habían sido sondados en el intraoperatorio y en los dos casos el 65% (n=40 y n=10 respectivamente) eran hombres. En la clasificación de la American Society of Anesthesiologist Physical Status Classification encontramos que los pacientes presentan ASA I 2% (n=1) versus 0%, ASAII 44% (n=28) versus 29% (n=4), ASA III 52% (n=32) versus 71% (n=10) y ASA IV 2% (n=1) versus 0%. El 24% (n=15) de los pacientes sin sondaje vesical tenía registrada patología nefrourológica previa (patología renal, de vías urinarias, vesical y/o patología prostática) versus al 35% (n=5) de los sondados intraoperatoriamente. En el intraoperatorio se colocó catéter paravertebral al 81% (n=50) versus al 64% (n=9) y catéter epidural al 2% (n=1) versus el 7% (n=1). Las características del intraoperatorio se observan en la tabla 1.
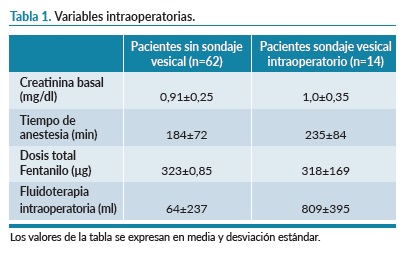
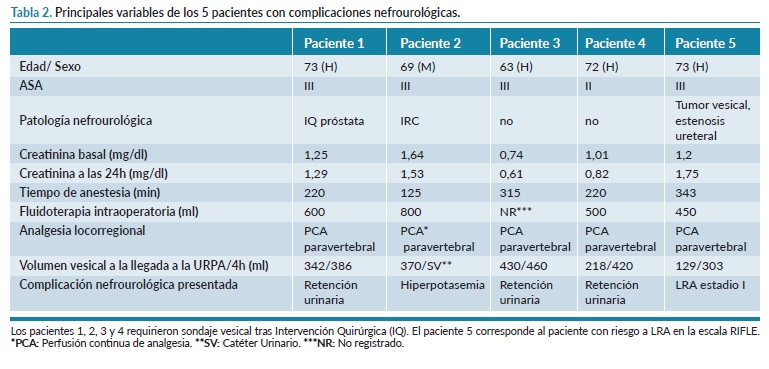
De los 62 pacientes que fueron ingresados en la URPA sin sonda vesical, 5 presentaron complicaciones nefrourológicas (8%). De estos pacientes, uno de ellos presentó LRA con un riesgo de estadio I por presentar un incremento de la creatinina sérica de 0,55 mg/dl en las primeras 24h tras la intervención quirúrgica y 4 de ellos requirieron sondaje vesical posterior, uno por hiperpotasemia y tres de ellos por retención urinaria. Las principales variables de estos pacientes se pueden observar en la tabla 2. No se objetivó ninguna infección de posible origen urinario.
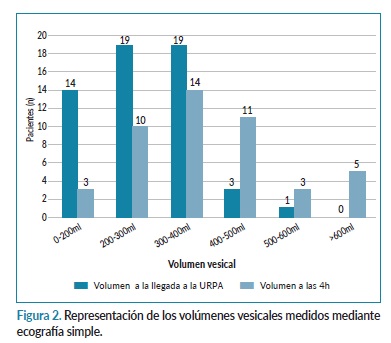
Los volúmenes vesicales medidos por ecografía simple se muestran en la figura 2. A la llegada a la URPA 14 de 56 volúmenes medidos (25%) eran inferiores a 200 ml mientras que a las 4 horas de estancia en URPA, 3 de 46 (6,5%) volúmenes medidos corresponden a dichos valores. Hubo un número de pacientes a los que no se les realizó ecografía vesical al ingreso, ni a las 4 horas (6 al ingreso y 16 a las 4h) ya que habían realizado la primera micción espontáneamente en la URPA o bien, no se les pudo realizar la ecografía vesical por las cargas de trabajo asistenciales en dicho momento. En cuanto a la relación de los volúmenes vesicales y las complicaciones nefrourológicas, se observa que los volúmenes vesicales medidos por ecografía en 3 de los 5 pacientes que presentaron complicaciones, fue superior a 300 ml a la llegada a la URPA, y tras las 4 horas, 4 de los 5 pacientes presentaban volúmenes superiores a 300 ml.
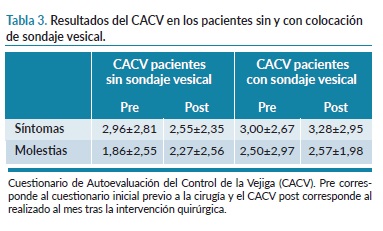
En cuanto a la sintomatología y las molestias del autocontrol de la vejiga tras la incorporación o no del catéter urinario se pueden observar en la tabla 3.
DISCUSIÓN
La evidencia respecto a la incidencia de complicaciones nefrourológicas en el paciente sometido a resección pulmonar es escasa. Los resultados de este estudio apuntan a que evitar de forma sistemática la colocación de sondaje vesical en los pacientes propuestos para resección pulmonar parece seguro pero que la incidencia de complicaciones no es despreciable.
El grado de adherencia a las recomendaciones ERAS de evitar el sondaje vesical ha sido del 82%. Al 18% de los pacientes sometidos a resección pulmonar por VATS se les colocó una sonda vesical intraquirúrgica. La recomendación de evitar el sondaje vesical parece apoyarse en que el tiempo quirúrgico es cada vez más corto, se realiza cirugía mínimamente invasiva y es una cirugía asociada a poco sangrado intraoperatorio1,2. Además, se trata de una cirugía en la que se intenta restringir el aporte de líquidos para evitar lesión pulmonar secundaria, lo que se asocia con una tendencia a la oliguria sin que necesariamente implique lesión renal o hipoperfusión si no existen otros datos como hipotensión, acidosis metabólica, elevación de niveles de lactatos o mala perfusión tisular2,8. Sin embargo, estas recomendaciones se establecen para la población general y la decisión de colocar sonda vesical debe ser individualizada en función de los antecedentes patológicos y curso perioperatorio.
Según nuestros hallazgos, la relación entre el uso o no del sondaje vesical y las complicaciones nefrourológicas ha sido escasa produciéndose en un 8% de los pacientes. Los casos que presentaron complicaciones corresponden a un caso de hiperpotasemia, otro caso sufrió riesgo de presentar LRA según la escala RIFLE y tres casos presentaron retención urinaria dentro de las primeras horas del postoperatorio. No se objetivó deterioro en la función renal durante el ingreso.
Algunos estudios muestran que la capacidad normal de la vejiga oscila entre los rangos de 400 a 600 ml14,15 y a pesar de que no existe evidencia respecto al tiempo que la vejiga puede permanecer llena sin repercutir en la retención urinaria, si hay estudios que han definido protocolos de actuación frente a unos volúmenes superiores a 200 ml tras las 4-6h de la evacuación preoperatoria tal y como Kun Woo Kim et al. muestran en su publicación7. En nuestro estudio 4 de los 5 pacientes que presentaron complicaciones nefrourológicas presentaron volúmenes vesicales medidos por ecografía simple superior a 300 ml. Por tanto, parece que la ecografía vesical en el postoperatorio inmediato podría ser una herramienta útil ya que permitiría cuantificar los volúmenes vesicales e identificar a los pacientes con volúmenes elevados para poder monitorizarlos, permitiendo entonces un seguimiento mucho más riguroso, transmitiendo la información de la URPA a la sala de destino postoperatorio lo cual facilita para poder adelantarnos a una futura retención urinaria. Además, la ecografía simple nos ha resultado una herramienta con una rápida formación, fácil para enfermería, siendo una técnica no invasiva que se puede realizar a pie de cama. Sería interesante también disponer de herramientas de valoración del riesgo a complicaciones nefrourológicas en el postoperatorio inmediato para discriminar qué pacientes de riesgo requieren de un seguimiento más intenso. Esto podría favorecer la utilización de recursos de una forma dirigida. En nuestro estudio, los pacientes que presentaron complicaciones fueron en su mayoría ASA III, presentaron cifras de creatinina basal superiores a 1 mg/dl, y tenían antecedentes de patología nefrourológica. Se requieren más estudios para validar estos hallazgos, pero la monitorización con ecografía simple en pacientes de riesgo podría ser de utilidad.
Respecto a la variable CACV, no podemos tener datos concluyentes dado a la escasa muestra de pacientes a los que se realizó el cuestionario y puede no haber sido útil para valorar la sintomatología miccional asociada a la utilización de sondaje vesical en el perioperatorio. Sin embargo, nos pareció interesante ya que el sondaje vesical se podría asociar tanto a una colonización como a una irritación de la vía urinaria y podrían aparecer síntomas miccionales en ausencia de infección del tracto urinario. El seguimiento postoperatorio se realizó tras un mes de la cirugía mediante una llamada telefónica que dificultó la recogida de todos los casos, no obstante, sería interesante tener una mayor muestra y poder comparar los casos con o sin colocación de sondaje vesical para poder analizar si hay diferencias significativas y confirmar la utilidad del CACV en este contexto.
Nuestro estudio presenta varias limitaciones. Se trata de un estudio observacional por lo que sólo permite establecer hipótesis de trabajo para que sean validadas posteriormente. Datos obtenidos en este estudio sugieren que la aplicación de escalas de riesgo de complicaciones nefrourológicas en el postoperatorio inmediato y el uso de la ecografía podrían ser útiles pero se requieren más estudios para confirmarlo. Otra limitación es el reducido tamaño de la muestra que puede haber sido insuficiente para detectar un número significativo de complicaciones.
A partir de los resultados observados podemos afirmar que no utilizar el sondaje vesical de manera sistemática en la cirugía de resección pulmonar por VATS, parece ser una práctica con baja incidencia de complicaciones nefrourológicas en el postoperatorio inmediato. Sería muy interesante disponer de herramientas que permitan una detección y monitorización de los pacientes con riesgo incrementado para favorecer la detección precoz de complicaciones. Se requieren más estudios para confirmar estos hallazgos y establecer escalas de valoración y protocolos de actuación.
BIBLIOGRAFÍA
1. Nicholson A, Lowe MC, Parker J, Lewis SR, Alderson P, Smith AF. Systematic review and meta-analysis of enhanced recovery programmes in surgical patients. Br J Surg. 2014;101(3):172-88.
2. Batchelor TJP, Rasburn NJ, Abdelnour-Berchtold E, Brunelli A, Cerfolio RJ, Gonzalez M, et al. Guidelines for enhanced recovery after lung surgery: recommendations of the Enhanced Recovery After Surgery (ERASVR ) Society and the European Society of Thoracic Surgeons (ESTS). Eur J Cardiothorac Surg. 2019;55(1):91-115.
3. Wind J, Polle SW, Fung Kon Jin PHP, Dejonj CHC, von Meyenfeldt MF, Ubbink DT, et al. Systematic review of enhanced recovery programmes in colonic surgery. Br J Surg. 2006;93(7):800-9.
4. Puckett JR, Pickering JW, Palmer SC, McCall JL, Kluger MT, De Zoysa J, et al. Low versus standard urine output targets in patients undergoing major abdominal surgery: a randomized noninferiority trial. Ann Surg. 2017;265(5):874-81.
5. Licker M, Cartier V, Robert J, Diaper J, Villiger Y, Tschopp JM, et al. Risk factors of acute kidney injury according to RIFLE criteria after lung cancer surgery Ann. Thorac. Surg. 2011;91(3):844-50.
6. Matot I, Dery E, Bulgov Y, Cohen B, Paz J, Nesher N. Fluid management during video-assisted thoracoscopic surgery for lung resection: a randomized, controlled trial of effects on urinary output and postoperative renal function. J Thorac Cardiovasc Surg. 2013;146(2):461-6.
7. Kim KW, Lee JI, Kim JS, Lee YJ, Choi WJ, Jung H, et al. Risk factors for urinary retention following minor thoracic surgery. Interact CardioVasc Thorac Surg. 2015;20(4):486-92.
8. Allen MS, Blackmon SH, Nichols FC, Cassivi SD, Harmsen WS, Lechtenberg B, et al. Optimal timing of urinary catheter removal after thoracic operations: a randomized controlled study. Ann Thorac Surg. 2016;102(3):925-30.
9. Egal M, de Geus HR, van Bommel J, Groeneveld AB. Targeting oliguria reversal in perioperative restrictive fluid management does not influence the occurrence of renal dysfunction: a systematic review and meta-analysis. Eur J Anaesthesiol. 2016;33(6):425-35.
10. Carrillo Esper R, Castro Padilla JF. Escala RIFLE. Fundamentos y su impacto en el diagnóstico, pronóstico y manejo de la lesión renal aguda en el enfermo grave. Rev Asoc Mex Med Crit y Ter Int. 2009;23(4):241-4.
11. Naruka V, Mckie MA, Khushiwai R, Clayton J, Aresu G, Peryt A, et al. Acute kidney injury after thoracic surgery a proposal for a multicentre evaluation (MERITS) Interact CardioVasc Thorac Surg. 2019;29(6):861-6.
12. Cardinale D, Cosentino N, Moltrasio M, Sandri M.T, Petrella F, Colombo A, et al. Acute Kidney injury after lung cancer surgery Incidence and clinical relevance, predictors, and role of N-terminal pro B-type natriuretic peptide, Lung Cancer. 2018;123(9):155-9.
13. Espuña Pons M, Puig Clota M, Rebollo Álvarez P. Validación de la versión en español del “Cuestionario de Autoevaluación del Control de Vejiga” (CACV). Un nuevo instrumento para detectar pacientes con disfunción del tracto inferior. Actas Urol Esp. 2006;30(10):1017-24.
14. Kelly CE. Evaluation of voiding dysfunction and measurement of bladder volume. Rev Urol. 2004;6(1):32-7.
15. Pavlin DJ, Pavlin EG, Gunn HC, Taraday JK, Koerschgen ME. Voiding in patients managed with or without ultrasound monitoring of bladder volume after outpatients surgery. Anesth Analg. 1999;89(1):90-7.
Este artículo se distribuye bajo una Licencia Creative Commons Atribución–NoComercial 4.0 Internacional.
https://creativecommons.org/licenses/by-nc/4.0/
